金币
UID746503
帖子
主题
积分1492
注册时间2021-9-24
最后登录1970-1-1
听众
性别保密
|
欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
线粒体是在大多数细胞中发现的细胞器,以产生为细胞功能提供动力所需的化学能而闻名。然而,越来越多的研究人员发现线粒体功能和功能障碍如何在许多疾病甚至衰老中发挥关键作用。
在2022年8月4日的《Immunity》杂志上发表的一项新研究中,加州大学圣地亚哥分校医学院和索尔克生物研究所的科学家报告了线粒体,炎症和DNMT3A和TET2之间的惊人联系,TET2是一对通常有助于调节血细胞生长的基因,但当发生突变时,与动脉粥样硬化的风险增加有关。
 [backcolor=rgba(18, 18, 18, 0.5)]​ [backcolor=rgba(18, 18, 18, 0.5)]​
编辑切换为居中
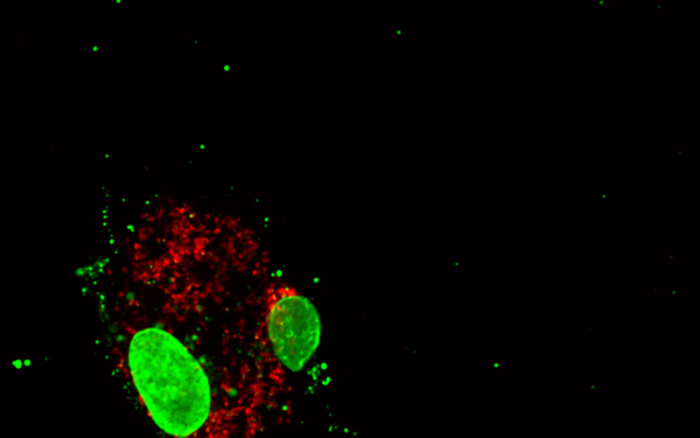
图像:在本显微照片中,在基因DNMT3A还原后显示人巨噬细胞(一种免疫细胞)。大的绿色结构是细胞的细胞核;红色表示存在细胞质蛋白。小绿点代表线粒体DNA,从细胞核逃逸到细胞质中,诱导炎症反应。
研究团队中的Gerald Shadel博士说:“我们发现基因DNMT3A和TET2除了改变化学标签以调节DNA的正常工作外,还直接激活了参与线粒体炎症途径的基因的表达,它们还与线粒体炎症途径相互作用,这可能是动脉粥样硬化治疗的新分子靶点。
在研究DNMT3A和TET2突变在克隆造血中的作用时,当干细胞开始制造具有相同基因突变的新血细胞时,与血细胞中DNMT3A和TET2缺乏相关的异常炎症信号传导在炎症中发挥了重要作用——促进动脉粥样硬化发展。
但问题仍然是DNMT3A和TET2基因如何参与炎症和动脉粥样硬化?
他们的发现
线粒体内有一个独特的细胞DNA子集,必须正确组织和浓缩以维持正常功能。Shadel的团队之前通过去除TFAM来研究线粒体DNA应激的影响,TFAM是一种有助于确保线粒体DNA正确包装的基因。
研究人员确定,当TFAM水平降低时,线粒体DNA从线粒体中排出到细胞内部,引发相同的分子警报,提醒细胞注意细菌或病毒入侵者并触发提示炎症反应的防御性分子途径。
为了更好地了解为什么DNMT3A和TET2突变导致类似于线粒体DNA应激期间观察到的炎症反应。研究团队应用基因工程工具和细胞成像来检查正常细胞的人的细胞,DNMT3A或TET2表达中功能丧失突变的细胞以及动脉粥样硬化的细胞。
他们发现,通过实验减少DNMT3A或TET2在正常血细胞中的表达,会产生与功能突变丧失的血细胞和动脉粥样硬化患者的血细胞相似的结果。在这三种情况中,炎症反应皆增加。
他们还观察到,血细胞中DNMT3A和TET2表达水平低导致TFAM表达降低,这反过来又导致线粒体DNA包装异常,从而引发由于线粒体DNA释放引起的炎症。
第一作者,Glass实验室的博士后学者Isidoro Cobo博士说:“我们发现DNMT3A和TET2突变阻止了它们结合和激活TFAM基因的能力,缺失或减少这种结合活性会导致线粒体DNA释放和线粒体炎症反应过度活跃,这可能会加剧动脉粥样硬化中的斑块积聚。“
Shadel说:“看到我们发现TFAM耗尽导致线粒体DNA应激和炎症现在与动脉粥样硬化等疾病直接相关,这是非常令人兴奋的”。“自从揭示这种途径以来,人们对线粒体参与炎症的兴趣激增,许多报道将线粒体DNA释放与其他临床环境联系起来。
靶向炎症信号通路的疗法已经存在于许多其他疾病中。Glass和Shadel认为,阻断加剧TET2A和DNMT3A突变患者动脉粥样硬化的途径可能构成新疗法的基础。来源:《Immunity》DNA methyltransferase 3 alpha and TET methylcytosine dioxygenase 2 restrain mitochondrial DNA-mediated interferon signaling in macrophages,Eurekalert
|
|
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033