欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x

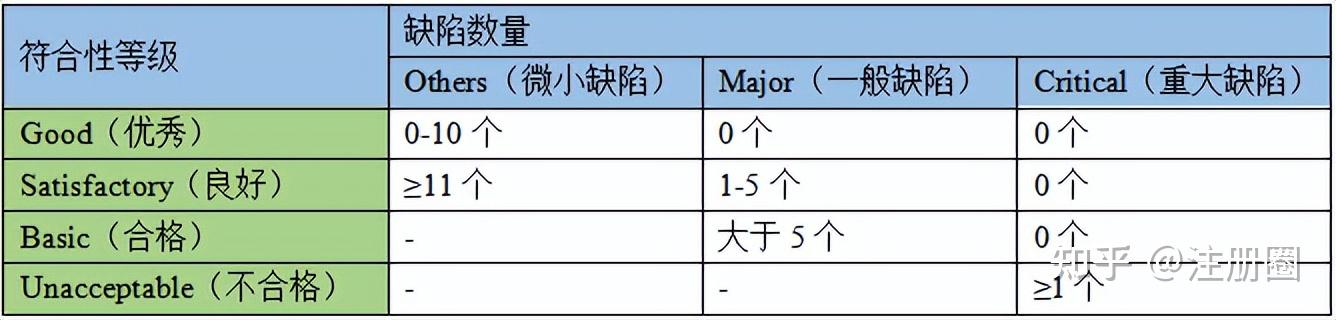
对于志在开拓东南亚市场的制药企业而言,菲律宾无论从地理位置还是人口结构来说,都是一个表现优秀的市场。获得菲律宾FDA的GMP认证,不仅是法规要求,更是产品质量的体现。菲律宾GMP检查严格遵循PIC/s指南,并且对细节极致关注。检查依据主要有以下三个:PIC/s GMP指南PE009-14及其相关附录,菲律宾《食品与药品管理法》RA(Republic Act)9711,行政命令A.O.(Administrative Order)2012-0008。 近日,笔者参与了一场菲律宾FDA为期数日的现场检查,并最终以“近乎零缺陷”的优异表现顺利通过。这场胜利,并非偶然,而是源于对标准的深刻理解、系统化的万全准备和现场专业从容的应对。笔者将结合陪审期间的经验所得和检查官的关注点,来深度复盘这场“大考”,也希望能给同行一些参考。 01 洞悉规则——菲律宾GMP检查的独特视角 笔者本次参与的检查,有三名检查官,共检查四天。菲律宾检查官有非常清晰的检查逻辑: 1. 流程导向的检查路线:检查严格遵循物料与产品流向,从仓库接收开始,到生产的每一环节、到取样送检至QC实验室,直至产品放行。这要求我们的质量体系必须是一个无缝衔接的闭环。 2. 分工协作与语言保障:本次三位检查官采用分工模式:组长与一员查看生产车间,另一员专查QC实验室。这意味着我们至少需要两组具备专业知识的陪检人员和翻译同步进行,任何一环的沟通不畅都可能造成误解。 3. 基于PIC/s指南的逐条核对:检查官在文件审查时会直接参照PIC/s指南条款,并索要相关SOP进行比对,其严谨程度可见一斑。 4. “看得见”的质量:检查官不固执于必须进入洁净区,但前提是通过观察窗或监控,他们能对关键岗位的操作和环境建立信心。因此,现场的定置管理、人员操作的规范性和可视化的良好印象至关重要。 02 万全准备——基于差距分析的精准整改 正式的检查通知会提前三个月由菲律宾官方通过邮件发送至进口商,进口商再通知生产企业。收到检查通知的那一刻起,公司的生产质量体系就应进入迎检状态。其实,在向官方递交PTR(与GMP体系相关的一套资料)时,公司就应做好迎检准备。临时抱佛脚很难通过检查,准备工作的核心是“模拟审计,精准整改”。 1. 成立跨职能迎检团队与模拟审计:建议组建覆盖质量、生产、QC、工程技术、仓储的核心团队,进行模拟审计。模拟审计完全仿照菲律宾检查模式,根据物料流向设计检查路线,确保每个环节都有专人负责,并能流利英文应答。 2. 合理利用外部资源帮助整改:为系统性弥补内部差距,建议引入第三方权威视角,聘请资深的GMP合规顾问进行模拟审计。旨在借助其丰富的迎检经验,精准识别因“熟视无睹”而难以发现的潜在缺陷,并就整改措施的有效性与合规性提供专业指导,从而确保我们的迎检准备工作经得起最严格的检验。 03 现场应对——专业、坦诚与沟通的艺术 现场检查是对准备工作的终极检验。 1. 开场亮相:在首次会议上,建议用准备好的厂区平面图、车间平面图、人物流图、洁净分区图进行讲解,直观地展示了工厂的合理布局和质量控制思路,奠定了专业的基调。生产企业需要按照菲律宾检查官的要求,准备中英双语的各类图纸,并用A3纸彩色打印给到每一位检查官。 2. 严格执行入场程序:检查官进入任何受控区域前,都需要由陪审人员严格按照SOP,利用图示和实物对其进行更衣培训,并在记录表上详细登记,一丝不苟的做法会给检查官留下了严格遵守GMP的第一印象。需要注意的是,菲律宾检查官要求退更流程及图示也需要张贴在更衣间。 3. 生产现场引导及沟通原则:在车间入口处介绍平面图和人物流走向后,从物料入口开始引导。岗位人员和陪检翻译人员始终坚持“问什么,答什么”的原则。对于挑战性问题,不延伸、不辩解,而是基于事实和文件,结合风险评估进行专业、坦诚的沟通。这种态度反而会赢得检查官的尊重和信任。 4. 高效的文档支持:操作现场的相关SOP及记录药按规定悬挂在固定区域,并定时定期维护,菲律宾检查官对记录的维护尤其关注。当检查官参照PIC/s条款索要相关文件时,需要快速响应,这是对文件管理能力的一种考查。 04 复盘与升华——将观察项转化为提升的阶梯 检查官提出的每一项观察和建议,都是我们宝贵的财富。建议容易整改的项目,在检查期间就立即展开整改行动,这样最终体现在检查报告上的缺陷项目就会尽可能少,能够最大可能的拿到最高的符合性等级。 菲律宾的GMP符合性等级评估如下:
以下是与GMP咨询专家交流后,总结出菲律宾现场检查中出现的典型问题与高频不符合项,旨在为同业提供详实的参考,助力企业对标自查,规避类似风险,持续优化质量管理体系。 ● 人员培训与行为规范 1. 对制水、灭菌等关键岗位的操作与监控,建议岗位相关人员快速并准确回答日常监控项目、频次、取样点、设备维护、清洗消毒规程等所有关键点。 2. 建议在更衣室醒目位置张贴包含退更流程的完整图示,图示需与SOP及现场设施(如衣物筐、洗手台)完全一致。只有更衣流程而缺少退更流程,也会成为一项缺陷。更衣室的镜子如是半身镜,建议更换为全身镜,确保员工可自查整体着装符合性。 3. 检查官格外比较关注《灯检人员管理制度》,需要在岗人员回答视力检查的标准(如视力要求、色觉要求)、体检频次(如上岗前、每年)、具体项目以及工间休息安排(如每工作1小时休息10-15分钟)。建议所有记录(体检报告、休息记录)归档备查,工作中的休息时间需要体现在批生产记录中,并签字复核。 ● 设备、设施与计量管理 1. 所有关键设备(如称量罩)、设施部件(如所有回风口)都需要有唯一性编号,并建立台账。确保现场无一仪器设备超校准有效期。校准证书需明确校准机构(内校或外校)、标准、频次和结果。对于关键工艺设备(如灭菌柜),应在其附近设置专用记录板,及时放置批生产记录和设备使用日志。 2. 对于器具存放间的软管等工器具,需要为每根软管配备标识卡,明确记录清洁人、清洁日期、有效期。同时,需要规定清洁后管口的保护方法(如使用无菌袋包扎)和存放要求(如悬挂,管口不得触地)。对于有破损风险的金属软管,立即更换并纳入预防性维护计划。 ● 生产与工艺控制 1. 对于灭菌柜,建议在现场张贴各种装载模式的示意图和操作要点。对于除菌过滤系统,建议准备一张系统流程图,清晰标注各级过滤器的安装位置、所属洁净区、滤芯孔径和编号,便于快速向检查官展示。 2. 对于金属检测仪和检重称,应基于风险评估,确定日常挑战测试的必要性和频次。若评估后认为必要,需订入SOP,规定每班次生产前使用标准测试块进行测试并记录。若评估后认为依靠定期验证即可,则必须准备好完整的验证报告和风险评估资料,以应对检查官的挑战。 ● 物料与仓库管理 1. 建议根据物料的特性(如蔗糖的吸湿性)来评估和规划仓库布局,确保存储条件最优。物料接收SOP需要明确对外包装的清洁消毒程序、查验运输途中温度记录的要求。严格区分研发与商业用途的物料/产品,并用醒目的标识和文件(如《研发物料台账》)进行隔离与管理。 2. 建议在SOP中明确规定物料称量后剩余物料的退库程序,包括密封要求、标签变更和账务处理。对标签等计数管理的包材,必须建立严格的收发存台账和计数复核程序,确保账物卡一致率100%。 迎检不是“应付检查”,而是对日常质量管理水平的一次“体检”和“校准”。成功的关键在于建立一个真正有效、持续运行的质量体系,并辅以充分、细致的准备和开放、专业的沟通心态。希望这份结合了实战细节的经验分享,能够为正在或即将踏上菲律宾国际认证的同行们提供一份有价值的参考。 声明:本文转载来源于公众号【注册圈】,文章版权归原作者所有,如若了解更多信息可自行前往查看。违规请版主删除。 更多资料请前往注册圈网站 注册圈 杭州几度数据技术有限公司
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033