欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
Chloroquine 氯喹是一种广泛用于疟疾治疗和类风湿性关节炎治疗的抗炎试剂,同时也是自噬(autophagy)和 Toll 样受体(TLRs)的抑制剂,能有效抑制 SARS-CoV-2(COVID-19)感染,其半数有效浓度(EC50)为 1.13 μM。
氯喹主要用作实验室试剂,凭借其溶酶体靶向剂和自噬抑制剂的特性,成为研究细胞过程的有价值工具。它作为自噬(一种细胞降解过程)的抑制剂,本质是一种弱碱,可扩散到溶酶体、内体等酸性细胞器中。在这些细胞器内,氯喹会发生质子化并被捕获,其积累会提高细胞器内部的 pH 值,进而抑制酸依赖性溶酶体酶的功能,阻止自噬体与溶酶体的融合,最终有效阻断自噬通量。
Chloroquine 氯喹作用机制与应用介绍 自噬与凋亡:氯喹广泛应用于体外实验中,通过提高溶酶体 pH 值来阻断自噬小体的降解,从而抑制自噬通量。这种机制帮助研究人员确定自噬在各种细胞环境中的作用,尤其是在癌症研究中,它常与其他抗癌药物联合使用以增强其效果。 细胞生物学与病毒学:作为一种弱碱,氯喹在酸性细胞内区室(如内体和溶酶体)中积累,增加其 pH 值。这种干扰细胞器酸化的作用被用于研究中介导的内体过程和病毒进入细胞,因为许多病毒需要低 pH 值进行融合和复制。 抗原呈递与免疫学:在免疫学研究中,氯喹通过干扰这些功能所需的酸性环境来抑制树突状细胞、B 细胞和巨噬细胞中的抗原处理和呈递。它还调节细胞因子产生和 Toll 样受体(TLR)信号通路。 DNA 相互作用:在分子生物学中,氯喹在高浓度下能嵌入双链 DNA,这一特性被用于研究 DNA-配体相互作用及其潜在的细胞毒性效应。 血库应用:磷酸氯喹(CDP)是血库实验室中一种有用的试剂,用于从红细胞中去除结合的 IgG 抗体,这允许对进行直接抗球蛋白试验阳性患者的表型进行准确分型和抗体鉴定。
Chloroquine 氯喹实验数据分享 体外研究(In Vitro) Chloroquine 氯喹(CHQ)在体外实验中展现出多方面的生物活性:20 μM 浓度下,它可抑制 IL-12p70 释放,降低活化的人单核细胞衍生朗格汉斯样细胞(MoLC)的 Th1 启动能力,同时还能增强 MoLC 中 IL-1 诱导的 IL-23 分泌,进而促进 CD4+ T 细胞释放 IL-17A [1];25 μM 浓度时,在亲本 MDA-MB-231 细胞中可抑制常氧和缺氧条件下的 MMP-9 mRNA 表达,且其对 MMP-2、MMP-9 和 MMP-13 mRNA 表达的影响具有细胞、剂量及缺氧依赖性 [2]。
此外,使用 IRS-954 或氯喹抑制 TLR7 和 TLR9,能在体外显著降低 HuH7 细胞增殖 [3];以 0.01-100 μM 浓度处理 Vero E6 细胞 48 小时,氯喹可有效阻断病毒感染,对 SARS-CoV-2 感染的抑制作用呈现低微摩尔浓度特性,半数有效浓度(EC50)为 1.13 μM [4]。其抗病毒机制主要是通过升高病毒 / 细胞融合所需的内体 pH 值,以及干扰 SARS-CoV 细胞受体的糖基化来实现 [4]。
体内研究(In Vivo)
Chloroquine (80 mg/kg,ip) 不会阻止原位小鼠模型中具有高或低 TLR9 表达水平的三阴性 MDA-MB-231 细胞的生长[2]。
使用 IRS-954 或 Chloroquine 抑制 TLR7 和 TLR9 可显著抑制小鼠异种移植模型中的肿瘤生长。Chloroquine也显著抑制了 DEN/NMOR 大鼠模型中 HCC 的发展[3]。
Chloroquine 氯喹应用案例分享 1、甘露糖通过代谢产物GlcNAc-6P激活AMPK拮抗GSDME介导的细胞凋亡 Cell Res. 2023 Jul 17.
用CQ(30μM)或MG 132(100 nM)预处理A375细胞2小时,然后用CCCP/FeSO 4加甘露糖处理24小时。微管蛋白用于确定负载蛋白的量。
摘要 焦亡是由 gasdermin 家族成员执行的一种调节性细胞死亡。然而,gasdermin 介导的 Pyroptosis 如何负调控仍不清楚。
在这里,我们证明甘露糖(己糖)可通过激活 AMP 激活蛋白激酶(AMPK),抑制 GSDME 介导的焦亡。
在机制上,己糖胺生物合成途径中的甘露糖代谢会增加代谢物 N - 乙酰葡糖胺 - 6 - 磷酸(GlcNAc-6P)的水平,该代谢物可结合 AMPK,促进其通过 LKB1 磷酸化。活化的 AMPK 进而在 Thr 6 位点磷酸化 GSDME,这一过程会阻断半胱天冬酶 - 3 诱导的 GSDME 切割,从而抑制焦亡。
AMPK 介导的 GSDME 磷酸化的调节作用,在 AMPK 敲除小鼠以及 GSDMET6 E 或 GSDMET6 A 敲入小鼠中得到了进一步证实。
在小鼠原发性癌症模型中,甘露糖给药可抑制小肠和肾脏中的焦亡,减轻顺铂或奥沙利铂诱导的组织毒性,且不损害抗肿瘤作用。
甘露糖的保护作用也在一小群接受常规化疗的胃肠道癌症患者中得到了验证。
我们的研究揭示了甘露糖通过 GlcNAc-6P 介导的 AMPK 激活来拮抗 GSDME 介导的焦亡的新机制,并表明甘露糖补充剂在减轻化疗诱导的副作用中具有临床应用价值。
2、OTUD6A对CDC6的去泛素化促进肿瘤进展和化疗耐药性
Mol Cancer. 2024 Apr 29;23(1):86.
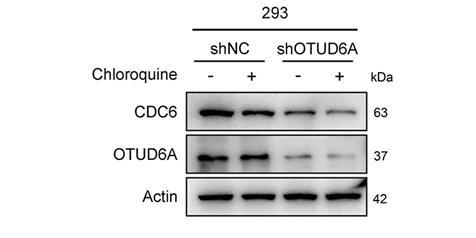
摘要 背景:CDC6是一种致癌蛋白,其表达水平在细胞周期中波动。虽然已经鉴定了几种负责泛素介导的CDC6蛋白水解的E3泛素连接酶,但尚未研究CDC6的去泛素化途径。
方法:采用全蛋白组去泛素化酶(DUB)筛选方法,对CDC 6的潜在调控因子进行鉴定。进行免疫荧光、蛋白质半衰期和去泛素化测定以确定CDC 6的蛋白质稳定性。进行了功能获得和功能丧失实验,以分析OUTD 6A-CDC 6轴对体外肿瘤生长和化疗敏感性的影响。采用N-丁基-N-(4-羟丁基)亚硝胺(BBN)诱导的条件性Otud 6a基因敲除(CKO)小鼠模型和肿瘤异种移植模型分析OTUD 6A-CDC 6轴在体内的作用。使用组织样本来确定OTUD 6A和CDC 6之间的关联。
结果:OTUD 6A通过去除K6-、K33-和K48-连接的多聚泛素化而与CDC 6相互作用、使CDC 6去聚泛素化并稳定化。此外,OTUD 6A通过上调CDC 6促进细胞增殖并降低对化疗的敏感性。CKO小鼠不太倾向于BBN诱导的BCa肿瘤发生,并且OTUD 6A的敲低抑制体内肿瘤进展。此外,OTUD 6A蛋白水平与CDC 6蛋白水平呈正相关,并且OTUD 6A和CDC 6蛋白水平高与膀胱癌患者的不良预后相关。
结论:我们揭示了一个重要但缺失的新DUB管理CDC 6稳定性。此外,我们的研究结果提出了OTUD 6A-CDC 6轴的模型,为细胞周期和化学敏感性调节提供了新的见解,这可能成为癌症治疗的潜在生物标志物和有前途的药物靶点。
参考文献 [1]. Said A, et al. Chloroquine promotes IL-17 production by CD4+ T cells via p38-dependent IL-23 release by monocyte-derived Langerhans-like cells. J Immunol. 2014 Dec 15;193(12):6135-43.
[2]. Tuomela J, et al. Chloroquine has tumor-inhibitory and tumor-promoting effects in triple-negative breast cancer. Oncol Lett. 2013 Dec;6(6):1665-1672.
[3]. Mohamed FE, et al. Effect of toll-like receptor 7 and 9 targeted therapy to prevent the development of hepatocellular carcinoma. Liver Int. 2014 Jul 2. doi: 10.1111/liv.12626.
[4]. Colson P, et al. Chloroquine and hydroxychloroquine as available weapons to fight COVID-19. Int J Antimicrob Agents. 2020;55(4):105932.
[5]. Savarino A, et al. The anti-HIV-1 activity of chloroquine. J Clin Virol. 2001;20(3):131-135.
氯喹机制明确、活性广泛,在自噬调控、抗病毒及肿瘤研究中作用突出,辅以扎实实验数据与应用案例,为相关领域研究及临床转化提供重要支撑,具广阔探索价值。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033