金币
UID743052
帖子
主题
积分4804
注册时间2021-9-13
最后登录1970-1-1
听众
性别保密
|
欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
01申报流程
Q:如图最下角的提示的话,现在的申请是不是都是先在药监局网上办事大厅申请,然后受理后了再到申请人之窗提交相关资料呢?
 [backcolor=rgba(18, 18, 18, 0.5)]​ [backcolor=rgba(18, 18, 18, 0.5)]​
编辑切换为居中
添加图片注释,不超过 140 字(可选)
A:(北京-注册-阿斯巴甜):是,申请(办事大厅)→提交资料(申请人之窗)→受理,给药审中心提交资料参考20221202关于药品注册申请电子申报有关要求的通知。同时要参考CDE 2023年3月29日发布的《关于电子证照附件格式变更的通知》。
02原辅包备案
Q:(广州-注册-leeann):BFS的瓶子要备案登记,制剂厂家可以备案吗?不需要制剂厂家有啥包材生产许可吧?
A1:(沪-打杂-���):可以。
A2:(四川-研发-笨笨熊):一般情况下谁生产谁去备案。不需要生产许可,关联审评。
03杂质计算
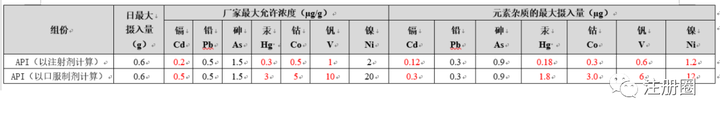
Q:(武汉-大蚂蚁):关于元素杂质的计算问题,某API为外购原料药均为注射级别,所以厂家提供的原料药的元素杂质限度按照注射剂的要求计算,现在我司采购该原料药作为固体制剂,我司在评估制剂元素杂质的时候是按照注射剂级别计算还是按照口服固体计算呢?
 [backcolor=rgba(18, 18, 18, 0.5)]​ [backcolor=rgba(18, 18, 18, 0.5)]​
编辑切换为居中
添加图片注释,不超过 140 字(可选)
A1:(上海-注册-贰雯):按注射级别,因为你买的是注射级的,算下来制剂风险会更低,审评更容易被接受。
A2:因为开发的是口服固体制剂,从成本控制角度,如果API价格上有下降,可以按口服制剂对API的要求来。
04溶出曲线
Q:(宁-打杂):溶出曲线12粒中如果某个取样点的其中1粒结果差异过大,是否能够直接剔除掉,统计11粒的结果呢?
A:(沪-打杂-���):不能,找出差异过大的原因,再投六粒溶出。
05发补资料
Q:(广东-化药-雪):原料药的发补资料,CDE会给出签收单的吗?
A:(江苏-化药注册-讨厌下雨天):我们去年发补的没给。
Q:(广东-化药-雪):那现在是不是在网上预约那里显示“已登记”,就说明CDE已经签收资料了?
A:(江苏-化药注册-讨厌下雨天):发补资料是的,新报资料补正资料还是有签收单,在网上预约显示已登记后1-2天平台会推送签收单。
06沟通交流会
Q:(山东-注册-Jessie):临床前的沟通交流会,提交支持性数据中,关于非临床安全性评价的部分,是需要提交完整的报告吗,还是说做完了试验,有初步的数据和结论就可以?
A:(上海-注册-贰雯):pre不用完整报告,但是你要保证数据和结论的准确性。
07BE试验
Q:(四川-注册-随心随缘):一个已上市的仿制药增加原研新增适应症还要做一次增加新适应症的健康人群的BE试验吗?
A:(沪-打杂-���):看这个适应症原研国内批准没有,有就补充申请。
Q:(四川-注册-随心随缘):国内已经上市的原研说明书都有这个新的适应症了,还需要做BE吗?
A:(沪-打杂-���):不用了,补充申请,申请豁免临床上市。
08延长效期
Q:(广东-化药-雪):原料药未获批上市,在审评期间延长有效期,是否要报补充申请?原来申报时填登记表时的有效期比现有的稳定性数据短,审评老师会不会最长只按照申报时的有效期批的?
A1:(上海-注册-贰雯):不用,跟审评老师问一下,能不能补稳定性数据。一般都行,然后直接补。所以补交稳定性数据,不走补充申请。
A2:按照《药品注册申请审评期间变更工作程序(试行)》,可以提交资料,稳定性没问题的话,批的时候有多长稳定性数据就批多长时间,上市后还可以走备案延长效期。
09电子申报资料
Q:(山东-注册-程程):电子申报的上市申报资料,每份文件除了电子签章,还需要每个文件制作册封皮吗?
A:(浙江Ra黄小懿):没有特别规定,但是我们也是都做了,签章盖在封面上。
10委托文书
Q:(浙江新药注册):境外企业委托我司做注册代理,这个委托文书怎么写,有没有模板可以参考?
 [backcolor=rgba(18, 18, 18, 0.5)]​ [backcolor=rgba(18, 18, 18, 0.5)]​
编辑切换为居中
添加图片注释,不超过 140 字(可选)
A:(黎敏聪):简单写一下:我是XXX公司的负责人XXXX,我公司名字为XXXX,药品名XXX,委托中国企业XXX,营业执照号XXXX,办理XXX品种的XXX的中国注册代理服务,期限从XXX到XXX。
公司名:
法人签字
文件记得去认证,交认证原件。
11上市申请
Q:(山东-注册-程程):目前电子申报的上市申请,还用做申报资料项目目录吗,如果做,放在哪个文件夹下?
A1:(长沙-注册-小张):可以放在申请信息那个文件夹。
A2:必要性不大,M1中已有“1.1 目录”。
12申办者变更
Q:(注册-Sxy):如果想买一个临床件,然后开临床时申办者就变成我司了(上市持有人为我司),是不是在临床登记平台走转让手续,就完成了申办者变更的合法手续,还需要其他手续吗?
A1:(北京~化学药品注册(CRO)~吕强):临床期间不需要做什么工作,NDA阶段需要和注册资料一起递交一个持有人变更的说明。
A2:中华人民共和国药品管理法实施条例(修订草案征求意见稿)》第二十条【申办者变更】 药物临床试验期间,变更申办者的,应当经国务院药品监督管理部门同意;必要时重新核发药物临床试验批准通知书。相应的药物临床试验义务和责任由变更后的申办者承担。
13安慰剂
Q:(中美华东注册指间沙):如果临床要用到安慰剂,那申报临床资料里需要有安慰剂的研究资料么?
A:(南京-注册-豆豆):需要的。
14原料药批量
Q:原料药大生产的批量范围怎么拟定呢,假如我想做的批量是25kg,但工艺验证三批批量范围是20-30kg,大生产批量是根据收率预估折算还是要和工艺验证保持一致呢?
A:(注册圈-苏州-江小白):工艺验证批和大生产一致。
15批记录
Q:(北京-注册-姜):3类仿制药申报的时候,批记录是交空白的就可以吗,还是必须真实的?
A:(注册圈-苏州-江小白):ANDA交生产的,空白不行。
16稳定性研究
Q:(糖葫芦兔兔):验证残留溶剂稳定性第一针不好,后面几针比较接近,怎么解决?
A:(长春-研发-melon):第一针不好是正常现象,第一针后再插个空白溶剂,然后再重头开始算第一针。
17参比制剂
Q:(左左右右):3类仿制是否必须先将国外原研申请进入国内参比制剂目录才可以?如果国外原研尚未在终稿进入参比制剂目录,而国内参比制剂目录也未有同品种,是否可以直接对照原研进行仿制?
A:(二当家):不可以,需要先进行参比制剂遴选上参比目录。
18场地变更
Q:(山东-质量-老宁):辅料在CDE上登记了,如果变更了生产地址之后,如何把登记信息改过来吗?改的话状态还会A变I吗?
A:(曾禹):如果是辅料登记主体没有变更,只是生产地址变更,需要在登记平台登记,状态不改变,如果是辅料登记主体不改变,增加新的生产地址,需要重新登记,状态为I,因为国内的每一个原辅包登记号都是只对应一个生产地址的。
19GMP符合性检查
Q:(果唯):原料药的GMP符合性检查是每个品种都核查,还是按照车间进行核查呢?
A:(雪):那是有共线的情况吗,软件每个产品都查,现场的话共线车间哪个产品动态就看哪个产品,申报几个车间就看几个车间。原料药是按照品种过GMP的。
Q:(果唯):假如我们要报1个车间,有3个产品共线。那检查的时候,3个产品的软件资料都会看,然后我们需要动态展示其中一个产品。可以这么理解吗?
A:(雪):我们经历的现在的模式是这样,选择风险大的产品动态,不知道各省的要求一样不一样,你们最好先跟老师沟通好。
20CTD资料
Q:(Xin):临床使用配伍稳定性试验放到CTD资料的哪一部分?
A:(RA-郭星星):相容性和使用中稳定性是两个概念,相容性是主药不受这些东西影响。比如冷藏储存的制剂,需要支持使用中能在室温保存2周,这个放P8,但为了说明你能用和氯化钠/葡萄糖去配伍的资料,则放相容性P2.6。
21IND申报
Q:(BL):IND申报时,要在申报资料里提到想要开展临床的医院吗?
A:(上海-新药-林):不需要。
22临床申请
Q:(上海-注册-il):临床申请中的临床计划和方案、知情同意书、研究者手册都不用签字是么?
A:(长春-研发-melon):是的。
Q:(上海-注册-il):风险管理计划也不用对吧?
A:(长春-研发-melon):我们IND的项目都没提供。
23注册分类
Q:(clf):有个品种,化学仿制药,参比制剂已公布,备注1:未在境内上市的原研,但是国内有同品种上市,也有已经获批的仿制药,我们是应该按照3类申报,还是4类申报,有没有具体的法规来源?
A:(HUANG):3类。主要看原研国内有没有上市。法规依据就是《化学药品注册分类及申报资料要求》“3类:境内申请人仿制境外上市但境内未上市原研药品的药品”。
24上市申报
Q:(Henry):制剂报上市大家会在制剂资料中提供原辅料残留溶剂申明吗?
A:(大脸猫大脸猫爱吃鱼):国内没交,报欧美的话就需要。
25临床豁免
Q:(北京-制剂研发-四叶草):对于3类豁免临床的产品,非临床资料和临床资料是不是都可以不体现了?
A1:(长春-研发-melon):不体现要说明理由。建议在2.4说明不体现或不提交非临床报告的理由;在临床模块中提交豁免临床的申请报告或者理由。
A2:(柴子坤):需要体现,里面写不适用,模块一说明函那边可以写无需开展临床研究的依据,也不能直接写申请豁免临床,我们当时写“申请豁免临床”被补正了。
26临床试验通知书
Q:(xzj):现在临床试验通知书上还写方案名称和编号吗?我了解到最新的通知书上好像只有药物名称和适应症了,没有方案名称日期编号了。
A:(深圳+注册+午后阳光):是的,我们去年年底拿到的临床试验通知书上已经没有试验方案名称和编号了。
27专利声明
Q:(天羊):仿制药上市申报做的三类专利声明,审评结束通过后,专利还未过期,会发批件吗?还是要等专利过期后发批件?
A:(刘成林):按照常理应该是发批件,专利到期前不能上市。
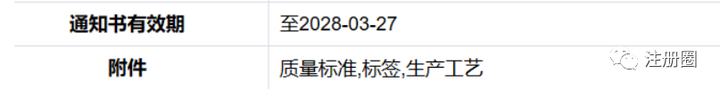
28原料药审评
Q:(讨厌下雨天):现在原料药单独审评批准通知书下来后,附件所说的质量标准、标签、生产工艺在哪里看?
 [backcolor=rgba(18, 18, 18, 0.5)]​ [backcolor=rgba(18, 18, 18, 0.5)]​
编辑切换为居中
添加图片注释,不超过 140 字(可选)
A:(彭彭):CDE原辅包平台该产品的文书打印那里。
29联合用药变更
Q:(上海-注册-Cally酱):刚拿到临床试验通知书,想变更联合用药,可以走补充申请吗?临床方案变更指南提到,增加联合用药,需要重新申报IND。不知道变更联合用药,算不算是增加联合用药呢?
A1:(长春-研发-melon):需要评估变更对安全性有效性的建立是否有显著影响,根据评估结果确定采取何种方式,如果安全性有效性建立的研究策略发生变化了,必需要重新提交IND。
A2:建议和CDE沟通下,这种情况比较复杂,如拟变更联合用的那个药是否已申报IND(或者已上市),进展到了什么阶段;原联合用药的IND进展到什么阶段等。
30临床适应症
Q:(eCTD-1群 Alice)一个原料药批准了,但是批件上写的需要对起始物料中的一个杂质进行研究,拟定必要的控制策略后方可上市,这种情况是将资料报给CDE吗?按照什么程序报(批件未要求申报)?
A:(注册圈):既然已经批准了,就只能走变更程序,根据描述,应该通过对起始物料的研究,重新拟定起始原料质量标准,根据品种情况,评估这个变更类别,然后备案或补充申请。
31原料药FDA申报
Q:(国际注册1群 Ben):原料药美国申报,基毒杂质和元素杂质的委外对委外检测单位有具体的资质要求吗?
A:(注册圈):目前未见对委外检测单位有具体的资质要求,但检测单位必需具备相应的检测能力(场地、人员、仪器、质量管理等),通过贵司的审计,能经受由申报品种引起的延伸现场核查。
声明:本文转载来源于公众号【注册圈】,文章版权归原作者所有,非官方问答,仅供参考。如若了解更多信息可自行前往查看。违规请版主删除。
|
|
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033