欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
线粒体是细胞内的能量转换细胞器,为细胞提供功能和完整性所需的大部分ATP分子,并参与细胞代谢、信号转导、分化、生长、凋亡和自噬等重要过程。在特殊情况下,线粒体会选择义无反顾牺牲自己,而保全细胞各项功能健全。
线粒体自噬是特异性的,可以通过自噬溶酶体选择性地清除受损、衰老或多余的线粒体,并回收其组成元素,维持线粒体网络的稳态,在细胞线粒体质量控制、发育等生理过程中起重要作用。目前,线粒体自噬被报道与许多生理和病理过程密切相关,比如衰老、神经退行性疾病和癌症。 近年来,PINK1/Parkin 介导的线粒体自噬受到越来越多的关注,并取得了显著的进展。这一途径包含多步骤激活,并涉及到非常多其他分子,增加了研究者对这一途径探索理解的难度。
PINK1的结构特征PINK1 是人类最具多样性的蛋白激酶之一,在物种间高度保守。它包含 N 端线粒体靶向定位序列(MTS)、跨膜结构域(TM)、不保守区域、Ser/Thr 激酶结构域以及一个功能和结构未知的保守 C 端区域(CTR)(图1.a)。 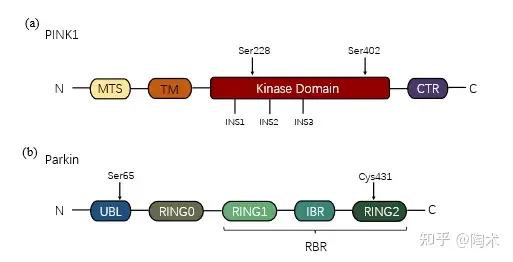
图1
PINK1有两种主要的亚型,表观分子量分别为 66 和 54 kDa,分别为 PINK1 进入线粒体剪切前的 PINK1 前体蛋白及剪切后形成的成熟 PINK1。 在正常生理条件下,通过线粒体膜电位的驱动,胞质中的 PINK1 前体蛋白 N-末端结构 MTS 可以通过线粒体内外膜进入线粒体基质中。随后,PINK1 前体蛋白被位于线粒体基质的加工肽酶(MPP)剪切了 MTS 序列。PGAM5 相关的菱形样蛋白酶(PARL)则在线粒体内膜上将 PINK1 前体蛋白上的 TM 序列剪切,形成成熟 PINK1,并被释放到细胞溶质中。 这两种亚型在人脑提取物和 PINK1 过表达细胞上均能检测到。胞质中的成熟 PINK1 会被蛋白酶体系统快速识别并降解,这就是 PINK1 虽广泛存在细胞组织中,但在正常情况下难以检测的原因(图2)。 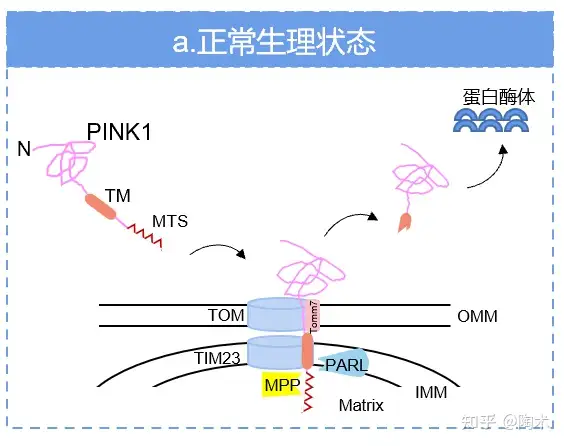
图2
实际上,EDMAN 降解分析显示,PARL 剪切 PINK1 的位点是在 Ala103 和 Phe104 之间,其中 54 kDa 片段在蛋白酶体抑制剂存在的情况下高度积累,表明 54 kDa 片段对蛋白酶体降解的敏感性高于全长蛋白。在 PINK1 蛋白功能和结构未知的 C-末端保守区域(CTR)发现含有一个或多个能够增强 PINK1 激酶活性的调控序列。当 C-末端结构发生缺失突变时,PINK1 激酶的活性下调并导致 PD,这可能是 PD 的其中机制之一。
Parkin的结构特征
Parkin 是一个 E3 泛素连接酶,包含一个 N-末端泛素样结构域(ubiquitin-like domain, UBL),以及四个锌指结构域,包括 RING0、RING1、IBR 和 RING2。其中,RING1-IBR-RING2 结构称为 RBR(RING-between-RING)。Parkin 中的UBL结构域被认为是具有负向的E3连接酶活性,因此,Parkin 以一种天然的自抑制构象存在细胞质中(图1.b)。 那么 Parkin 是如何被 PINK1 激活转变为活性构象呢? PINK1 首先磷酸泛素化 Parkin UBL 区域的 Ser65 位点。由于 RING1 具有典型的泛素连接酶环状结构,它可以与 E2 泛素连接酶结合,并将泛素转移到 RING2 中的 Cys431,形成一个泛素-硫酯中间体。而 Parkin UBL 结构域在 Ser65 位点的磷酸化以及 IBR 和 RING2 结构域的突变可能会破坏 UBL 结构域与 RING0 的结合,增加 Parkin 对激活的敏感性。
蛋白质进入线粒体
线粒体是一种具有双层膜结构的细胞器,蛋白质通过双层膜进入线粒体需要特殊的膜蛋白结构协助。 在线粒体外膜(OMM)上定位的外膜转位酶(TOM)复合物和在线粒体内膜(IMM)上定位的内膜转位酶(TIM23)复合物是PINK1前体蛋白进入线粒体所需的必要结构。TOM复合物包括三个表面受体(TOM20、TOM 22、TOM 70)、一个易位孔(TOM 40)和三个亚基(TOM 7、TOM 6、TOM 5)。
有报道称, TOMM7 的缺失完全阻断了 PINK1 在线粒体外膜上的积累,但通过 TOM 复合物进入线粒体的蛋白并没有被阻断,这表明 TOMM7 亚基可能在通过 TOM 复合物向线粒体外释放蛋白方面起重要作用,如成熟 PINK1 等。而 PINK1 前体蛋白 MTS 结构通过线粒体内膜上的 TIM23 复合物主要依赖于线粒体膜电位。
PINK1/Parkin介导的线粒体自噬
由于线粒体损伤和线粒体膜电位降低,PINK1 通过 TIM23 复合物进入线粒体的途径被破坏,其确切机制尚不清楚。PINK1 前体蛋白被 PARL 和 MPP 的剪切过程也被阻断,所以 PINK1 前体蛋白与 TOM 复合物相互作用并稳定在 OMM 上。随着 PINK1 在 OMM 不断累积,PINK1 分子之间发生二聚化并自磷酸化而变得非常活跃。
随后,活化的 PINK1 磷酸化泛素上的 Ser65 位点和与泛素结构相同的 Parkin UBL 区域的 Ser65 位点,磷酸化 Parkin 与磷酸化泛素结合诱导两者构象变化,极大的刺激了 Parkin 和 E3 连接酶的活性。
磷酸化 Parkin 在受损线粒体上积累的机制尚不完全清楚,但据报道显示,活化的 Parkin 可以定位于含有外膜锚定泛素链的线粒体上。线粒体受到损伤时会被一组多聚泛素链连接修饰。线粒体外膜上的多聚泛素链作为 Parkin 受体协助 Parkin 在线粒体外膜上累积,驱动受损线粒体的清除,启动线粒体自噬(图3)。 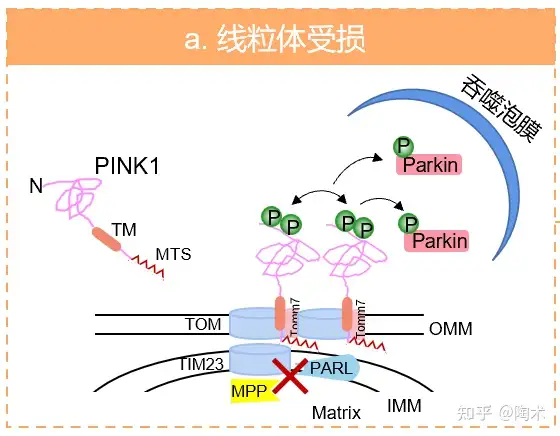
图3
线粒体自噬是一个非常复杂的过程,涉及到很多不同的蛋白分子。募集自噬受体到受损的线粒体泛素链上是线粒体自噬过程中形成自噬泡的必要条件。使用基因编辑的方法将 HeLa 细胞中的 TAX1BP1、NDP52、NBR1、p62 和 Optineurin 5 种自噬受体敲除后,会发现 NDP52 和 Optineurin,是 PINK1/ Parkin 介导的线粒体自噬的主要受体。
此外,NDP52 和 Optineurin 不仅可以进一步将 LC3 上游的自噬受体 ULK1、DFCP1 和 WIPI1 募集到受损的线粒体附近,还可以通过 LC3 相互作用区 (LIR) 与 Atg8 同源蛋白 (LC3/GABARAPs) 结合,帮助 Atg8s 募集自噬因子,促进自噬小体生长,增强选择性自噬。
但有研究发现,LC3/GABARAPs 的缺失并没有阻止自噬小体的形成,而是影响了自噬小体形成的大小和效率。在 PINK1/Parkin 介导的线粒体自噬和饥饿情况下,Atg8 家族的 GABARAP 亚家族可以促进 PLEKHM1 的募集,并主导自噬体-溶酶体融合。
此外,有一种新的由泛素蛋白酶体系统(UPS)介导的线粒体蛋白溶解的方式被提出。泛素蛋白酶体系统介导的线粒体膜不稳定使得线粒体内压升高和线粒体内膜在外膜上的固有压力升高,导致线粒体膜破裂,产生的线粒体碎片被溶酶体溶解清除。
PINK1 通过选择性地在膜电位降低的线粒体上累积,促 进 Parkin 磷酸化并向受损的线粒体转移,参与线粒体自噬的激活。这个过程对线粒体整个网络的功能完整性起着重要的作用,而其确切调控机制尚未明确,这便需要投入更多的精力去研究其每一步的调控机制。
关注公众号、知乎、哔哩哔哩:陶术生物,第一时间掌握全球药物研发资讯~ 本文不是治疗方法推荐,仅作学习交流之用,如有需要,请及时前往正规医院就诊! 参考文献: [1] Schubert A F, Gladkova C, Pardon E, et al. Structure of PINK1 in complex with its substrate ubiquitin[J]. Nature, 2017,552(7683):51-56. [2] McWilliams T G, Muqit M M. PINK1 and Parkin: emerging themes in mitochondrial homeostasis[J]. Current Opinion in Cell Biology, 2017,45:83-91. [3]Sekine S, Youle R J. PINK1 import regulation; a fine system to convey mitochondrial stress to the cytosol[J]. BMC biology, 2018,16(1):2-12. [4]Padman B S, Nguyen T N, Uoselis L, et al. LC3/GABARAPs drive ubiquitin-independent recruitment of Optineurin and NDP52 to amplify mitophagy[J]. Nature Communications, 2019,10(1). [5]Padman B S, Nguyen T N, Lazarou M. Autophagosome formation and cargo sequestration in the absence of LC3/GABARAPs[J]. AUTOPHAGY, 2017,215(6):857-874. [6]Goiran T, Duplan E, Rouland L, et al. Nuclear p53-mediated repression of autophagy involves PINK1 transcriptional down-regulation[J]. Cell Death & Differentiation, 2018. [7]Goiran T, Duplan E, Rouland L, et al. Nuclear p53-mediated repression of autophagy involves PINK1 transcriptional down-regulation[J]. Cell death and differentiation, 2018,25(5):873-884. [8]Liu K, Lee J, Kim J Y, et al. Mitophagy Controls the Activities of Tumor Suppressor p53 to Regulate Hepatic Cancer Stem Cells[J]. Molecular Cell, 2017,68(2):281-292. [9]Yamada T, Yamada T, Dawson T M, et al. SQSTM1/p62 promotes mitochondrial ubiquitination independently of PINK1 and PRKN/parkin in mitophagy[J]. Autophagy, 2019,15(11):2012-2018. [10]Rakovic A, Ziegler J, Mårtensson C U, et al. PINK1-dependent mitophagy is driven by the UPS and can occur independently of LC3 conversion[J]. Cell Death & Differentiation, 2019,26(8):1428-1441. [11]Yang Q, Sun G, Yin H, et al. PINK1 Protects Auditory Hair Cells and Spiral Ganglion Neurons from Cisplatin-induced Ototoxicity via Inducing Autophagy and Inhibiting JNK Signaling Pathway[J]. Free Radical Biology and Medicine, 2018,120:342-355.
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033