欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
揭秘!注射用水能否停机验证,重启清洁!
引言: 注射用水(Water for Injection, WFI)系统不允许进行传统意义上的“停机验证”,非传统意义上理论可以进行“停机验证”。传统意义这一结论基于全球药品生产质量管理规范( GMP)的核心要求、科学风险控制原则及WFI系统的特殊性质。以下从法规依据、风险分析、科学原理及替代方案四个维度展开论述
关键词:注射用水、WFI、内毒素(热原)、停机验证、重启验证、制药用水、制药用水系统、生物膜、BCC、洋葱伯克霍尔德菌、洁净区、洁净室、无菌室、无菌环境、无菌参数、管路设计、PCR技术、快速检验技术、注射用水重启。
一、法规与指南的明确禁止
GMP核心原则
《药品生产质量管理规范》明确要求:关键公用系统需保持“持续验证状态”。WFI作为无菌药品生产的直接接触介质,其质量直接影响产品无菌性、热原控制等关键属性。停机操作(如计划性停止运行)等同于主动破坏系统验证状态,违反“持续受控”的基本原则。
Oxytech
权威指南的针对性条款:
EU GMP Annex 1 (2022):第6.6条强调“WFI系统需持续循环于70°C以上(或采用等同控制手段),不得停滞”。 FDA《高纯水系统检查指南》:明确禁止通过停机模拟验证微生物控制能力,因停机状态与正常运行条件存在不可比性。 PDA TR 69(生物膜控制策略):指出任何停顿均会显著增加生物膜形成风险,此类操作无法被验证接受。
Oxytech
二、停机操作的本质风险
(一)微生物与内毒素失控 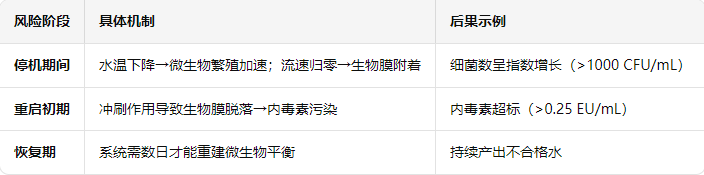
Oxytech
(二)材质与化学稳定性破坏
不锈钢管道钝化层失效:停滞水相导致氯离子局部浓缩,诱发点蚀(ASTM A967标准)。 TOC升高风险:有机溶出物(如管道润滑剂)在静置状态下释放速率提高3-5倍(ISPE数据)。
Oxytech
三、“停机验证”的科学无效性
(一)验证逻辑缺陷
传统验证依赖“最差条件”测试,但停机状态不属于可接受的“挑战条件”,而是系统性偏差: 停机无法模拟“偶尔发生的意外中断”(如电源故障),因其发生概率、持续时间不可预测; 计划性停机人为规避了真实故障中的关键变量(如温度梯度突变、压力波动)。
Oxytech
(二)数据不可靠性
若强行进行停机测试: 取样失真:重启后首批水样仅反映冲刷污染,不代表系统恢复能力; 监测盲区:离线检测无法捕捉生物膜形成的动态过程(需在线生物膜监测仪); 统计失效:微生物生长呈随机爆发式,单次测试无统计学意义(需≥30次独立事件)。
Oxytech
四、应急响应:非计划中断的验证
偏差处理程序
定义“最大允许中断时间”(基于生物膜模型计算,通常≤1小时); 超标响应流程:排放初期水样→持续冲洗至≥3倍系统体积→密集取样(每阶段5分钟)直至达标。
Oxytech
恢复验证
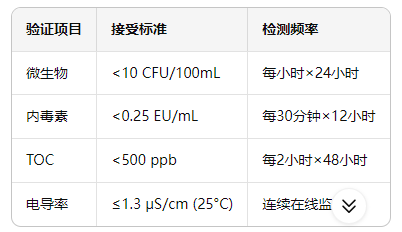
Oxytech
五、重启验证————清洁灭菌
新厂筹备与系统重启都需要进行完整的清洁灭菌与验证,尤其是旧系统不可抗停机后,短时间内微生物负荷会大幅增加、生物膜爆发形成风险、内毒素超标,种种后果会严重影响到我们的重启验证与后续无菌生产。
Space Day of China 我们要如何处理降低风险:
面对微生物负荷大幅增加、生物膜爆发、内毒素超标,我们要用高品质的消毒剂进行辅助灭菌,协同达到无菌标准!
Space Day of China 选择合适的消毒剂进行消毒灭菌可以有效的解决注射用水系统停机与重启问题,从源头治理微生物确保不因内部遗留因素进一步造成实质影响。
Space Day of China
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033