欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
《强标、变更和延续》 十一放假归来,大家已经正式的回到了工作状态,但是对于药监在十一之前发放的法规大礼包,我们依然也还在学习消化当中。其中有这么几个关于延续的内容: 《医疗器械延续注册申报资料要求及说明》中: - 如医疗器械注册证有效期内有新的医疗器械强制性标准发布实施,已注册产品为符合新的强制性标准所做的变化属于应当办理变更注册的,注册人应当提交申请延续注册前已获得原审批部门批准的变更注册(备案)文件及其附件的复印件。 - 如在原医疗器械注册证有效期内发生了涉及产品技术要求变更的,应当提交依据变更注册(备案)文件修改的产品技术要求。 《国家药品监督管理局关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项的通告(2021年第76号)》中 三、关于新的强制性标准实施之日前受理注册申请项目的审查 对于申请注册的医疗器械,其产品技术要求中引用的强制性标准发生变化的,除国家药监局在发布实施标准文件中另有规定外,在新标准实施之日前受理注册的,可以按照原标准进行审评审批。自新标准实施之日起,企业应当全面实施新标准,产品应当符合新标准要求。 《医疗器械注册与备案管理办法》中 第八十三条 有下列情形之一的,不予延续注册: (二)新的医疗器械强制性标准发布实施,申请延续注册的医疗器械不能达到新要求; 我们先假设一个强标实施日期  和延续上交截止日期 
在原先,在延续的时候,如果有强制性标准更新,一般企业会采用下面这种流程:
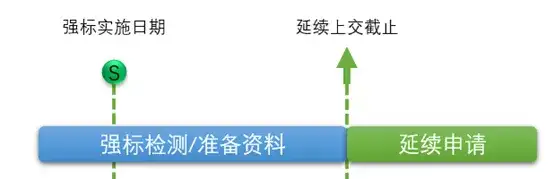
图1 – 原来的延续流程 那按照新的法规要求,需要对强制性标准进行变更,才能延续,也就是:
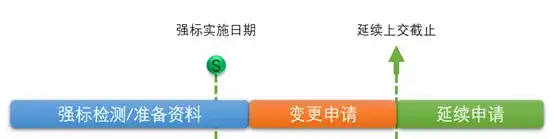
图2 – 现在的延续流程要求 变更和延续作为两个独立的过程,企业现在就要提前计划好时间。 好比说这么两种可能的方式:

方式1:(即上述图2)
这种方式,我们觉得更适合那些有非常充裕时间(距延续上交截止日期一年半以上)的产品证书。 方式2:
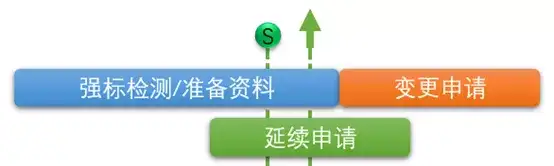
这种方式,我们觉得更适合那些强标实施之日与延续上交日期接近的产品。也就是在实施之前先进行延续申请,同时并行进行变更申请,以避免错过延续申请期限,或者导致延续注册批准的日期延后。 当然方式1也可能转化成方式2,这就要动态的去看了。比如说按照方式1进行,但随着项目进展,预计没有办法在强标实施后,到延续上交截止日期之前这个阶段中完成变更,那还是早做延续递交为好。 通过上述,我相信大家也明白了,核心,在于“强制性标准实施日期”和“延续递交日期”到底留给我们的时间有多少。 这就不得不提到那些在23年要延续的产品了,9706.1的三版标准是必须要提前考虑的。所以建议企业在“延续递交日期”之前一年半左右时间,就开始确定强制性标准的事情。 如下是一些即将实施的标准的截图参考,电气安全和电磁兼容赫然在列。
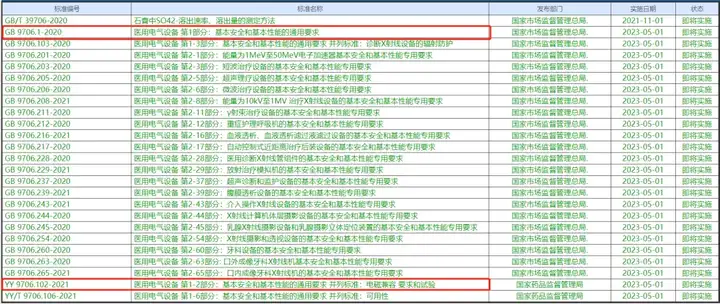
当然,不管方式1,还是方式2,都还有一些不确定的因素在。比方说: - 新的标准在实施前,哪些检测所,在什么时候,才能有能力进行检测。这影响到项目启动的时间 - 产品检测不通过,进行了耗时漫长的整改 - 新的法规要求的发布,导致了额外的要求,导致资料准备,或者发补准备时间延长 - 新“制定”的标准的发布,使得企业需要考虑新的标准 - 等等 额外注意,强标实施之后,企业必须确保产品符合强制性标准,而不是说已经递交了变更申请,但是还没有获批,或者还没有递交变更申请,就不用符合了。所以一旦有了新的标准出现,企业就需要花力气去研究,落实。 下面放上参考的一些法规,希望企业能够注意。 《中华人民共和国标准化法》 第三十六条 生产、销售、进口产品或者提供服务不符合强制性标准,或者企业生产的产品、提供的服务不符合其公开标准的技术要求的,依法承担民事责任。 第三十七条 生产、销售、进口产品或者提供服务不符合强制性标准的,依照《中华人民共和国产品质量法》、《中华人民共和国进出口商品检验法》、《中华人民共和国消费者权益保护法》等法律、行政法规的规定查处,记入信用记录,并依照有关法律、行政法规的规定予以公示;构成犯罪的,依法追究刑事责任。 《医疗器械标准管理办法》 第二十五条 医疗器械企业应当严格按照经注册或者备案的产品技术要求组织生产,保证出厂的医疗器械符合强制性标准以及经注册或者备案的产品技术要求。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033