欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
本文章详细说明一下,医疗器械出口需要满足的各项法规要求,建议收藏点赞!
1、首先是欧盟,医疗器械在欧盟需要满足MDR的法规要求,MDR中对于产品的分类如下:
一、I类低风险,一般是非侵入式器械,此类风险等级比较低,出口前企业需要满足:
①欧盟授权代表
②SRN注册
③完整的技术文件
④UDI申报数据库(UDI是通过GS1编码转换)
⑤DOC
此处提醒:低风险的医疗器械是不需要第三方机构介入审核,所以不存在CE证书,都是满足法规要求后,通过自我声明的形式出口
二、风险等级较高,需要公告机构介入审核并出具CE证书的产品,覆盖的分类如下:I类灭菌、I类重复使用、I类带测量、IIa类、IIb类、III类,对于这类器械企业需要准备的工作如下
①和欧盟公告机构机构签订认证合同
②准备CE技术文件和ISO13485体系文件(其中临床评估报告是难点)
③根据产品技术要求,完成性能测试和其他测试
④欧盟授权代表、SRN注册和UDI申报数据库
文件和测试准备好后,找公告机构审核,审核完成后会出具型式检验证书,就是CE证书
(关于CE如果有问题可以后台详细沟通!)
2、美国FDA
医疗器械出口美国,需要先去FDA官网找到和自己产品对应的FDA code,网站如下:Product Classification
通过产品名称,点击搜索,可以找到相关代码,如:手术衣(Surgical gown)
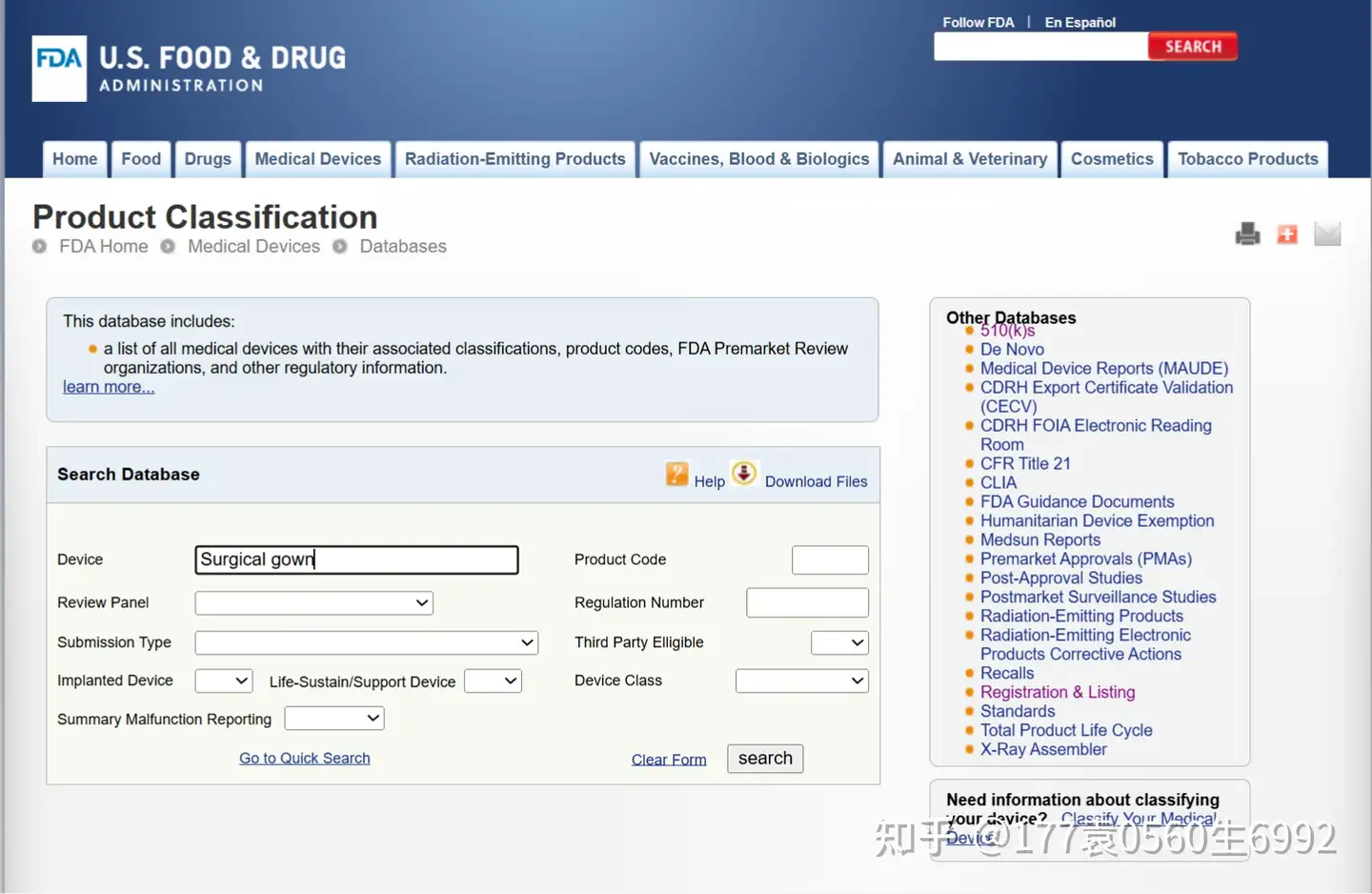
搜索页面点击搜索后,会出现如下界面:
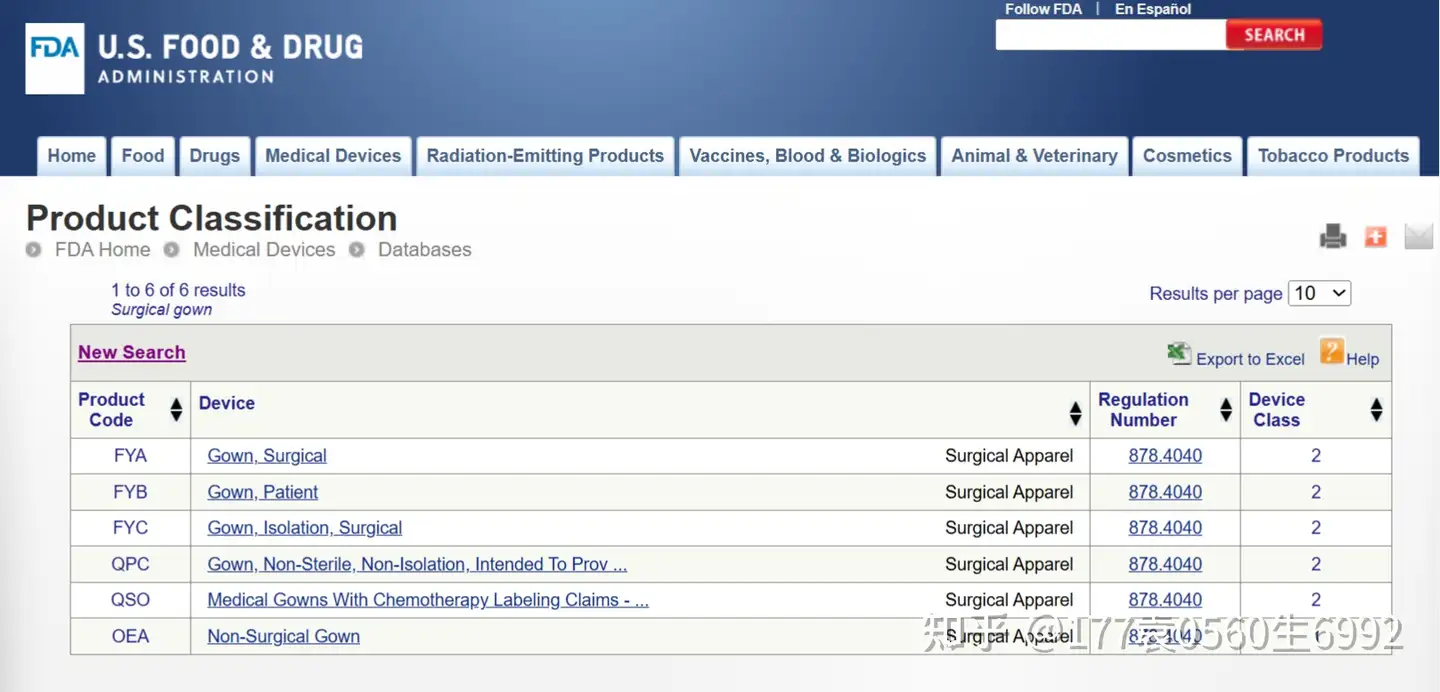
搜索截图
会出现一些产品合适的描述,前面会有product code,找到和自己产品预期用途想同的描述,美国FDA510K和产品是否是1类还是2类无关,主要和代码有关,然后点击产品描述,会出现如下界面:
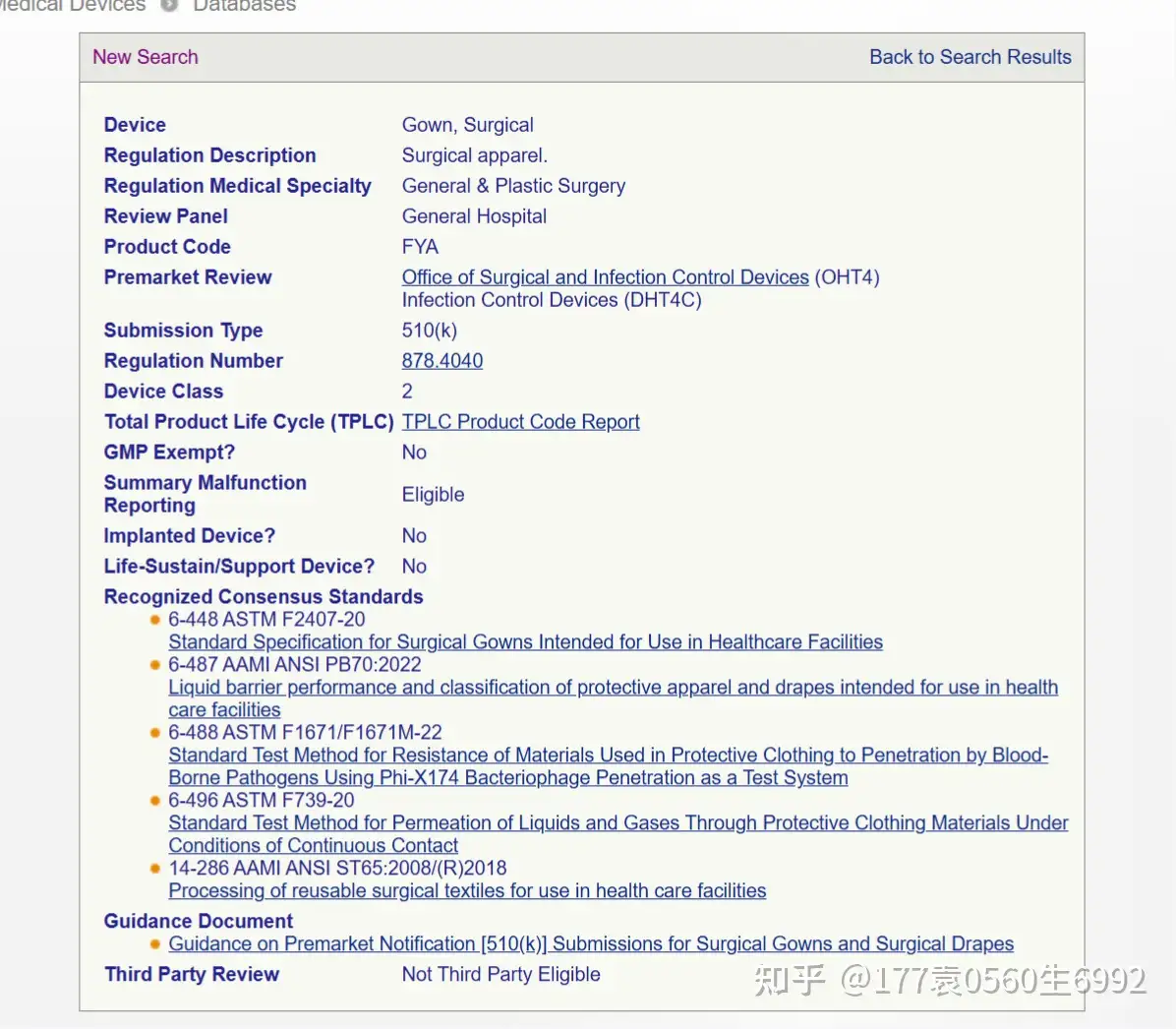 这里我们要关注一下:Submission Type,这里写的是510K,那么产品就需要拿到K号以后才可以完成注册!如果显示的是 ,那么无需申请510K,可以直接完成注册
如果是 产品,您需要准备的工作如下: ①美国代理人 ②在FDA官网进行列名和注册(无需检测,但是FDA有年费) 整个周期大概2周内可以完成,FDA每年都要更新 如果是510K的产品,您需要工作如下:①美国代理人
②要找到一款和自己产品类似,并且已经拿到510K的产品作为竞品(没有竞品就要做临床试验)
③和竞品做比对测试
④编制FDA510K文件
⑤技术文件和测试报告递交给FDA审核,审核整改完成后,会拿到K号(FDA会有官费)
⑥用K号去完成FDA官方的列名和注册(FDA有年费,每年更新)
提醒:FDA没有证书,所有注册和K号均会公开在FDA官网
三、医疗器械沙特注册:
最近沙特那边市场比较火爆,很多企业也开始开发沙特市场,并取得了非常丰硕的订单,那么医疗器械出口沙特需要满足什么内容呢?
沙特对于医疗器械的分类和欧盟是完成一致,分为A B C D类,沙特注册流程如下
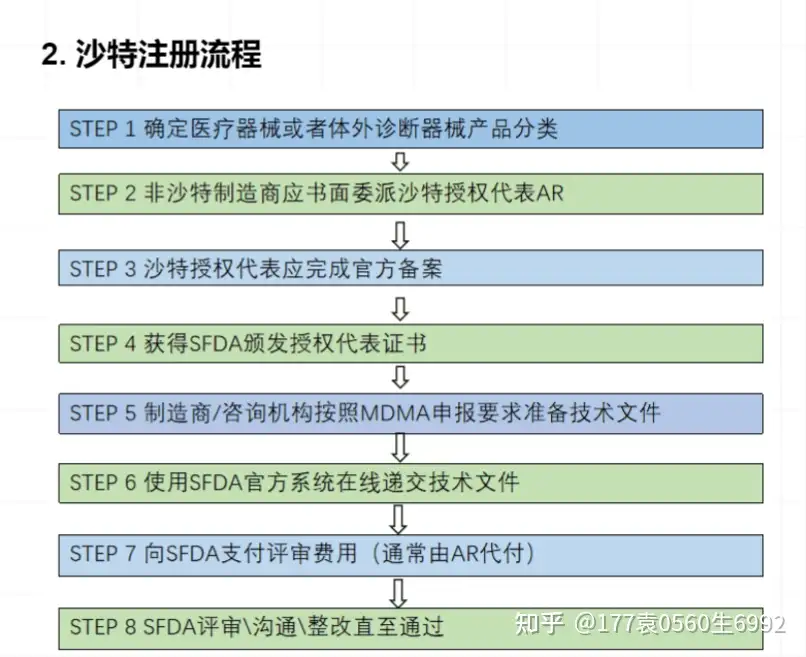 企业办理沙特注册必要的一些文件如下:
1,需要沙特代表(此处要注意,很多客户是沙特客户,这样的情况下,如果后续有其他客户还要买产品的话,是不可以满足其他客户的要求的)
2,需要ISO13485证书(必须要带国际认可标志)
3,检测报告(主要是性能测试和生物学报告)
4,技术文件,整体技术文件要求和CE比较类似
以上准备齐全后,就可以开始申请沙特注册了,A类周期大概2个月左右,B C D则根据具体产品不同,审批速度也不同,附上沙特ARL证书和MDMA证书样本 
四、医疗器械巴西注册
首先了解一下巴西注册的专业术语:
ANVISA-Brazil National Health Surveillance Agency
巴西国家卫生监督局 BGMP-Brazilian Good Manufacturing Practice}
巴西良好制造规范 INMETRO- 巴西国家计量、质量和技术研究院ANATEL-巴西通讯管理局INCQS-巴西国家卫生质量控制研究所
ANVISA对于医疗器械的主要要求: •所有在巴西进口或分销的医疗器械,必需进行ANVISA认证; •ANVISA认证后,产品认证结果会公布在Brazil‘s Official Diary (DOU)日报; •完成ANVISA认证后,产品会列出ANVISA数据库; •除了ANVISA认证,某些产品需要INMERTO/ANATEL认证(下面会介绍什么情况下需要满足INMERTO/ANATEL认证)
ANVISA分类如下:
产品分类: Class 1 Class 2 Class 3 Class 4 分类规则:和CEMDR分类规则基本一致;
注册流程如下图: 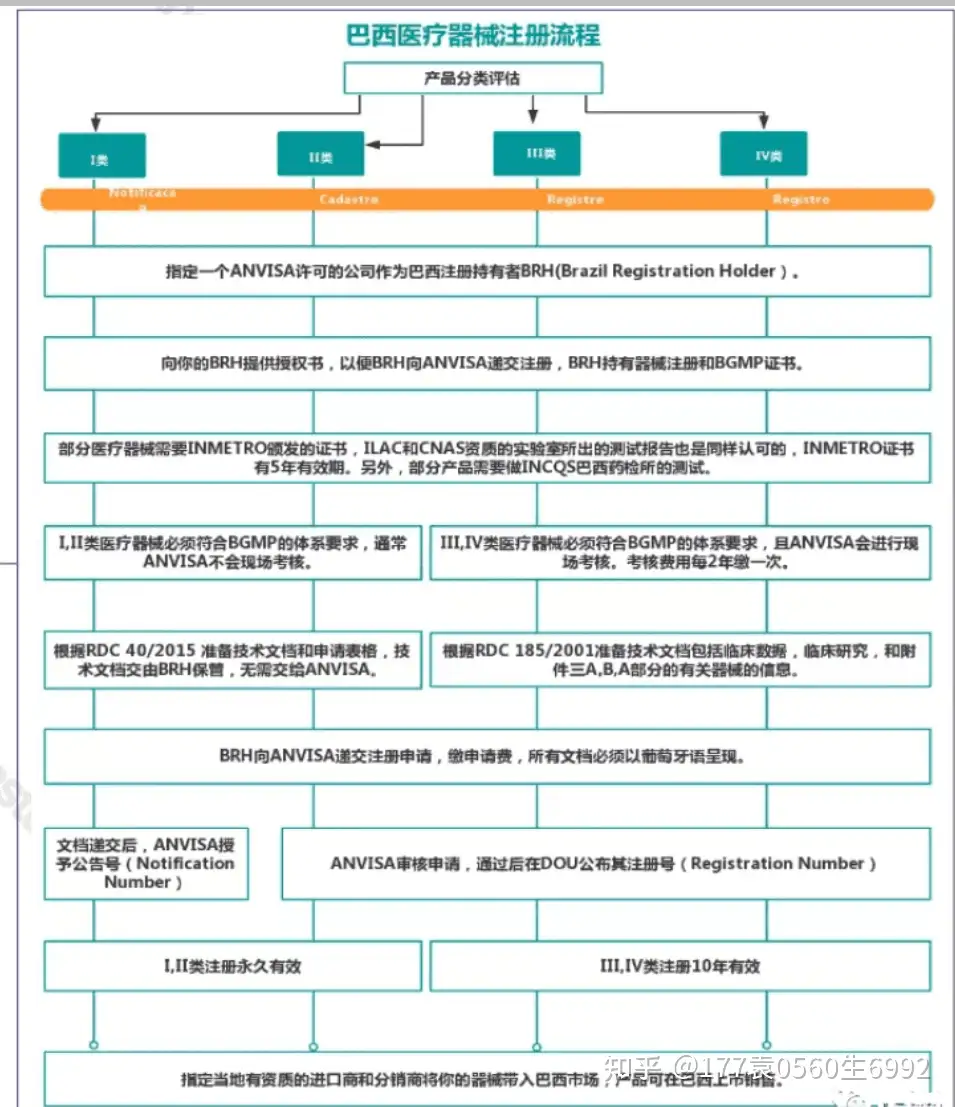 那企业需要满足什么要求呢?如下
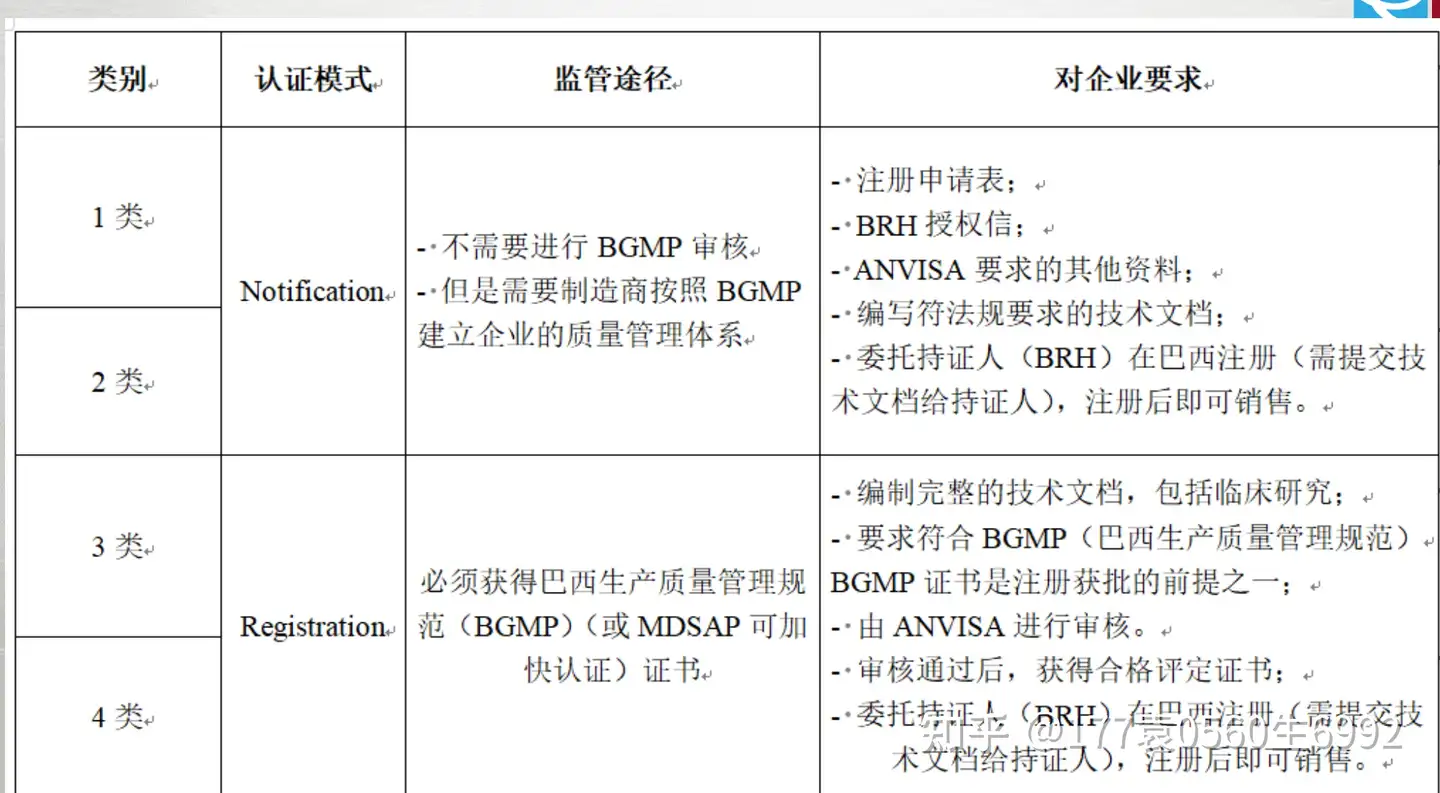 此外,任何风险等级的产品,若满足以下条件,必需申请相应的认证:
1.INMETRO认证-巴西国家计量,标准化与工业质量协会 - INMERTO认证由巴西认证机构,或第三方机构(如,SGS,UL,TUV莱茵等)进行 - 强制INMETRO认证的产品: •有源医疗器械 •部分无源器械:皮下注射针,无菌注射器,乳房植入物,手术/检查手套,避孕套等; - 不强制认证的产品,可以做自愿性INMERTO认证 - INMERTO认证需要BRH授权信- INMERTO认证是ANVISA注册的申请文件之一; - INMERTO证书没有有效期,需要定期维护; 2.ANATEL认证-巴西国家通讯管理局 - 主要负责通讯产品认可的官方机构; - 对于带通讯功能的医疗器械,需要额外的ANATEL认证,如射频RF,蓝牙,无线通讯等; - ANATEL认证是ANVISA注册的申请文件之一 - 需要在巴西本地测试
3. INCQS测试-National Institute for Quality Control in Health 巴西INCQS是巴西政府授权直接执行健康测量的单位。 它是与食品,药品,化妆品以及透析和健康用品,诊断试剂盒,诊断试剂和用品,消毒产品,血液和血液制品,环境健康和生物制品的质量控制有关的实验室分析问题的国家参考。 •在巴西境内进行测试 •只有ANVISA有资格提出:在ANVISA审核期间,如果认为这个产品需要进行INCQS测试,他会告知这个产品需要测试,要求将产品送到官方指定的实验室进行评估 •如新冠试剂,乙型和丙型肝炎试剂,登革热试剂等; üIV类:Immunohematology, Hepatitis B and C,Syphilis,HIV,Chagas,HTLV üIII类:Dengue,Chikungunya üSARS-CoV-2 •制造商一定要确保产品的性能和质量是符合要求并且稳定的,在应对INCQS测试时,通过测试的概率会比较大;
此外,企业还需要巴西授权代表:
巴西授权代表-Brazil Registration Holder (BRH) 通常成为巴西授权代表或巴西注册信息持有人,是巴西境外制造商与当局的联络人,负责制造商在巴西医疗器械的注册登记和上市后监管的相关事宜 •BRH是产品持证人,和制造商一样对产品的质量和上市后监督负责; •BRH需要获得相关的资质,即来自ANVISA的营业许可(AFE); •BRH是产品注册的官方联络人,BRH的信息将公布到ANVISA注册登记的 材料上; •BRH 还参与与分销商协调每批货物的进口授权。 •在注册登记过程中,负责ANVISA与制造商的联络工作,并且在ANVISA 有要求的情况下提供技术文档 •代表制造商提出BGMP的体系审核 •协助进行器械注册登记的更新 •协调经销商出具授权信函(进口许可) •在发生召回或事件报告时向制造商提供协助
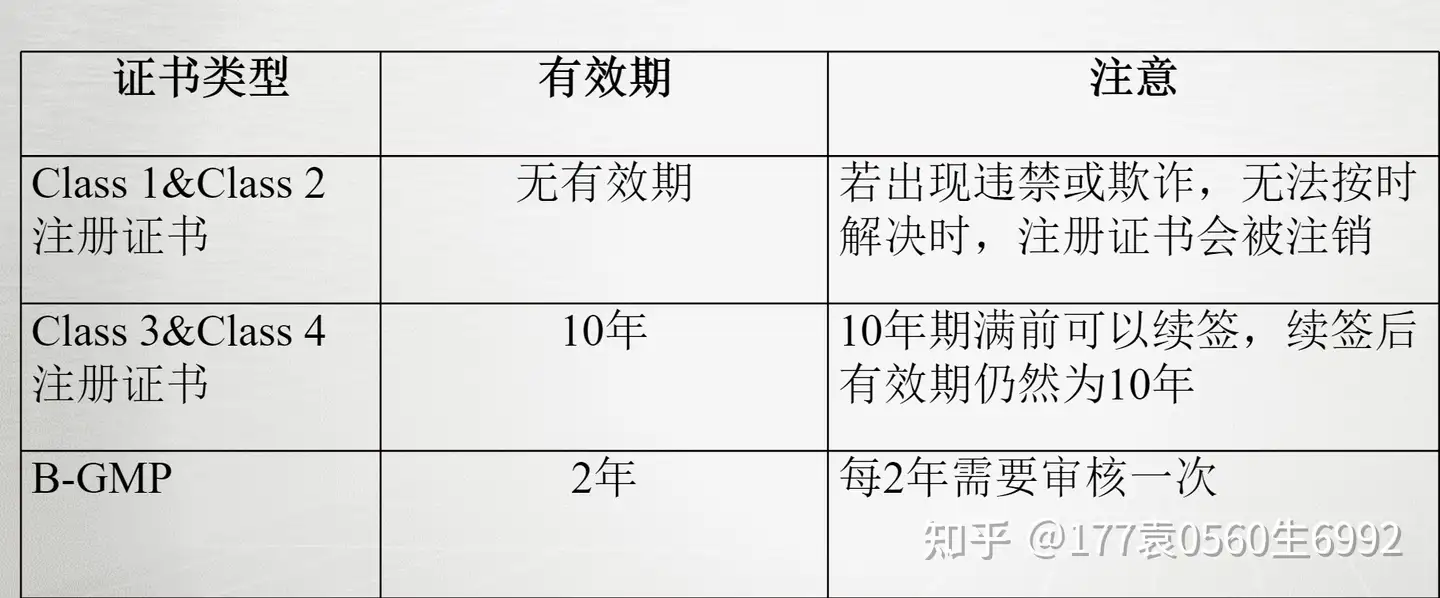
巴西注册的有效期如下:
 5、加拿大注册
加拿大注册分类查询网址如下:
https://health-products.canada.ca/mdall-limh/prepareSearch?type=active
根据分类规则,找到合适的分类,目前加拿大注册路径如下:
1.I类器械需要满足MDEL注册,I类器械不分产品,是以企业为单位注册,注册需要支付加拿大年费,周期大概1个月左右
2,2类器械需要满足MDL注册,企业需要满足MDSAP体系,完成后去递交MDL申请,整体周期大概8~10个月
6,澳大利亚TGA注册
澳大利亚注册比较简单,分类和MDR保持一致,注册流程如下:
一类的产品企业需要准备的资料如下:
1,澳洲代表
2,支付官费
3,递交TGA注册
整个周期大概1个月左右可以完成
二类产品需要准备资料如下:
1,确认产品是否拿到过CE证书、FDA注册和加拿大注册
2,准备资料递交给TGA审核
周期大概3个月左右
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033