欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
嘿!你对细胞间通讯还仅停留在囊泡运输吗?非也,细胞器是动态互作的整体。本期我们就一起来了解下膜接触位点 (MCS)、运输机制及其衔接蛋白的鉴定,当然还有几种细胞器间的相互作用,以及细胞互作的表征。干货满满,速来! 首先,问大家一个问题:“你知道各个细胞器间是如何通信的吗?”
 图源: Nature. 2019 Mar;567(7747):162-164. 很长一段时间里,人们认为,大多数细胞内的物质输送都是通过名为囊泡的泡状囊来实现的。这些囊泡就像“快递员”一样,将物质包裹起来,从一个细胞器运送到另一个细胞器。诺,就是下面这些:
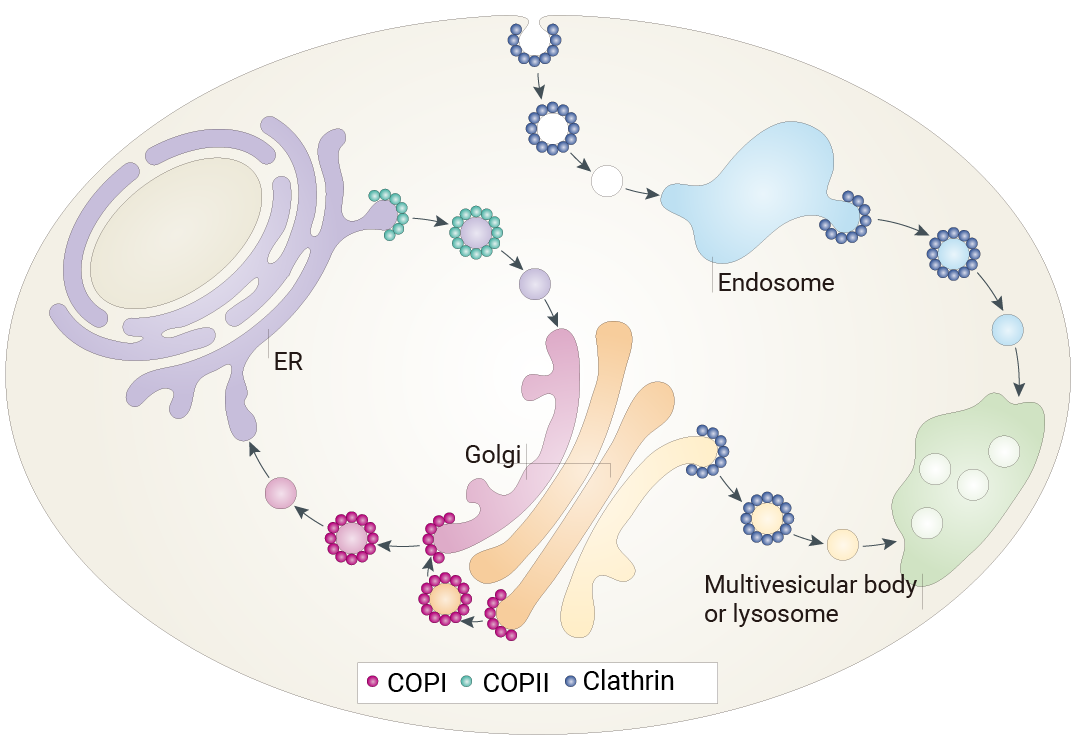 图 1. 三类囊泡运输通路的示意图,箭头指示囊泡运输方向[1]。 已经较为明确的包膜蛋白所介导的囊泡运输途径。包膜蛋白 ii (cOPii;绿色) 形成用于从内质网 (ER) 向高尔基体进行顺向运输的囊泡;而 cOPi (红色) 则形成用于高尔基体内部运输以及从高尔基体向内质网进行逆向运输的囊泡。壳蛋白 (蓝色) 基于其与不同衔接蛋白 (APs) 的结合而形成多个复合物。与 AP1 和 AP3 结合的壳蛋白形成用于从跨高尔基体网络到后续内吞细胞器运输的囊泡,以及来自早期内吞细胞器的运输;与 AP2 结合的壳蛋白则形成从质膜产生的运输至早期内体的囊泡。 詹姆斯·罗斯曼 (James E. Rothman)、兰迪·谢克曼 (Randy W. Schekman) 和托马斯·聚德霍夫 (Thomas C. Südhof) 3 位科学家也因发现囊泡转运机制——细胞中的主要运输系统——被授予 2013 年诺贝尔生理学或医学奖。 然而,细胞器的功能远比科学家预想的要复杂得多。 因为!细胞器并非是孤立的,而是作为动态互作的整体。所有细胞器之间都存在功能性的紧密接触,这些接触通常被称为膜接触位点 (MCS)[2]。
Section.01 膜接触位点 (MCS) 膜接触位点 (Membrane contact sites, MCS):指两个细胞器在不发生膜融合前提下的紧密相互作用区域 (通常在30-50 nm以内,但有时更远)。将细胞器固定在 MCS 处的蛋白质复合物可以插入 MCS 处的细胞器内部,也可以与相对膜上的蛋白质或脂质结合。这些复合物通常被称为系链,除了物理连接之外,它们在这些位点通常还具有其他功能,例如内质网-线粒体接触位点促进 Ca2? 转移、线粒体分裂、细胞内信号传导和脂质代谢。 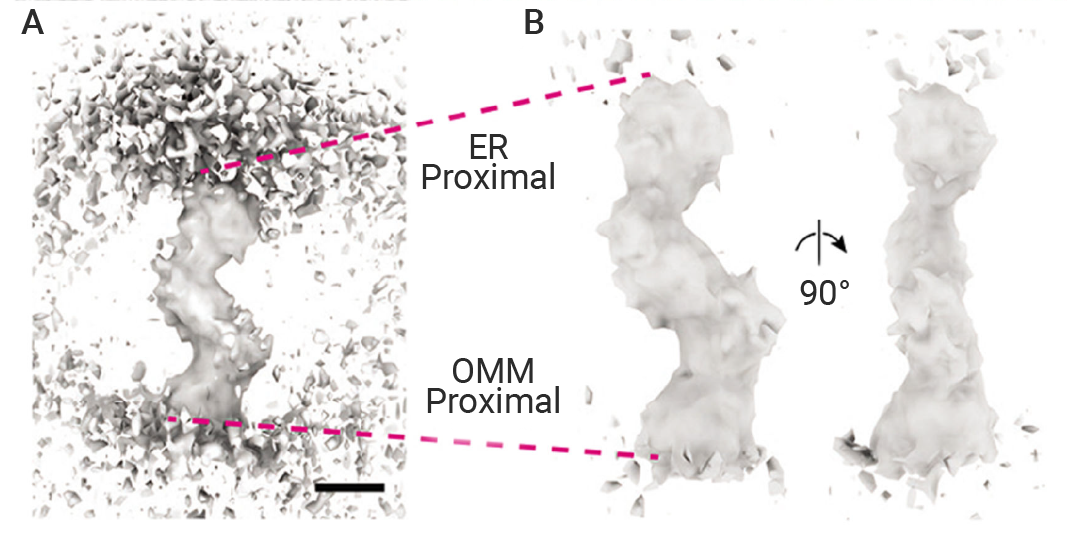 图 2. 内质网-线粒体接触结构(ERMES)介导的 MCS 由连接两个膜的桥状结构组成[3]。 数据分析结果显示,在 ER 和线粒体的 MCS 处,存在许多密集的桥梁状结构,这些结构跨越两个细胞器之间的间隙,整体长度为 24.2 nm ± 4.76 nm。 MCS 的运输机制 膜接触位点 (MCS) 在胆固醇和其他脂质在细胞区室间的非囊泡转运中起着核心作用。这种转运需要一种称为脂质转运蛋白 (LTP) 的蛋白质,其特征是能够在体外促进膜间的脂质交换。 LTP 家族结构多样,但其作用机制大致可分为两类:脂质穿梭转运蛋白和形成脂质通道的蛋白。大多数穿梭转运蛋白在一个疏水裂隙或沟槽中结合单个脂质单体。在某些情况下,结合的脂质还被一个盖结构域屏蔽,使其与水相隔绝。这些 LTP 可以从膜中提取脂质,将其转运穿过水相,并递送到另一膜 (图 3A)。许多 LTP 还具有辅助结构域,使其定位到接触位点。 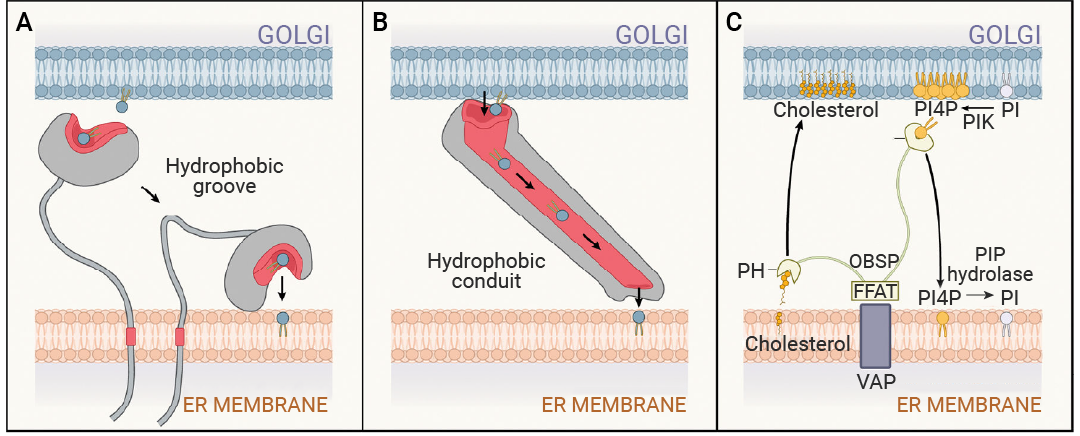 图 3. 膜接触位点促进细胞器之间的脂质转移[2]。 (A) 具有疏水沟槽或口袋的脂质转运蛋白从供体细胞器膜 (蓝色) 中提取磷脂,并催化其转移到受体细胞器膜 (灰色)。疏水沟槽在转运过程中保护脂质免受胞质溶胶的影响。(B) 具有管状疏水通道的脂质转运体形成稳定的脂质转移途径,用于在系留细胞器膜之间转移脂质。(C) 脂质转运蛋白在膜接触位点 (MCS) 处调节细胞器膜的脂质组成。尽管内质网 (ER) 中的胆固醇水平远低于高尔基体,但 OSBP 仍能将胆固醇从内质网转运至高尔基体。为了实现这一目标,OSBP 将高尔基体脂质 PI4P 与内质网胆固醇进行交换。在内质网中,PI4P 水解为 PI 以维持较大的 PI4P 浓度梯度。 近几年,人们发现了一类新的脂质转运蛋白 (LTP) 家族,其作用机制似乎有所不同。该家族中的蛋白质被称为 Vps13 样蛋白或重复 β-沟槽 (RBG) 基序桥状蛋白,它们被认为能够形成大型 (10-25 nm) 的刚性结构,该结构具有贯穿整个蛋白质长度的疏水沟槽 (图 3B)。 此外,磷脂酰肌醇 (PIP) 及其前体在膜接触位点 (MCS) 的运输需要在这些位点发挥作用的脂质转运蛋白 (LTP) (图 3C)。 随着细胞器之间接触位点的逐步揭示,我们对细胞器功能及其整合运作方式也有了新的认识,许多衔接蛋白已被鉴定,但肯定还有更多有待发现!
如何鉴别 MCS 处的衔接蛋白? Schuldiner 和 Einat Zalckvar 团队曾系统地绘制了酵母细胞中所有的接触点,并展示了一种鉴别衔接蛋白的方法。他们在研究报道中选择基于双分子荧光互补分析 (Bimolecular fluorescence complementation assay)——可视化已知接触位点的有力工具——系统地鉴定和表征细胞器之间的接触位点。 简而言之,使用了一种分裂式荧光探针,Venus 荧光蛋白的一半包被每个细胞器的周边。在两个细胞器之间的接触位点区域,两半 Venus 荧光蛋白相互作用,形成完整的荧光团 (图 4)。 图 4. 分裂型 Venus 接触位点报告蛋白的示意图[4]。 作者将 Venus 荧光蛋白(VN)的一半与定位于一个细胞器的膜蛋白融合,并将 Venus 蛋白的另一半(VC)与定位于另一个细胞器的膜蛋白融合。只有当两个细胞器彼此靠近时,例如在接触位点,才会发出荧光信号。 细胞器膜接触位点的存在表明,定位于两个不同细胞器的因子可以聚集在一起,协同参与细胞器的附加功能[5]。接下来,我们一起来看几种常见的细胞器互作~
Section.02 细胞器的相互作用 内质网-线粒体 细胞器的相互作用通常发生在膜接触位点 (MCSs),其中以膜性细胞器内质网最为核心。同时,线粒体-内质网是最早被观察到也是研究最多的细胞器互作类型,通过荧光显微镜和电子显微镜可以观察到内质网和线粒体在多个接触位点连接在一起形成特定区域,称为线粒体-内质网相关膜 (Mitochondriaassociated membrane,MAM)[2]。 虽然内质网和线粒体膜紧密接触形成特定的接触位点,但两个细胞器并不融合,其结构、功能和特性都得到了保留。 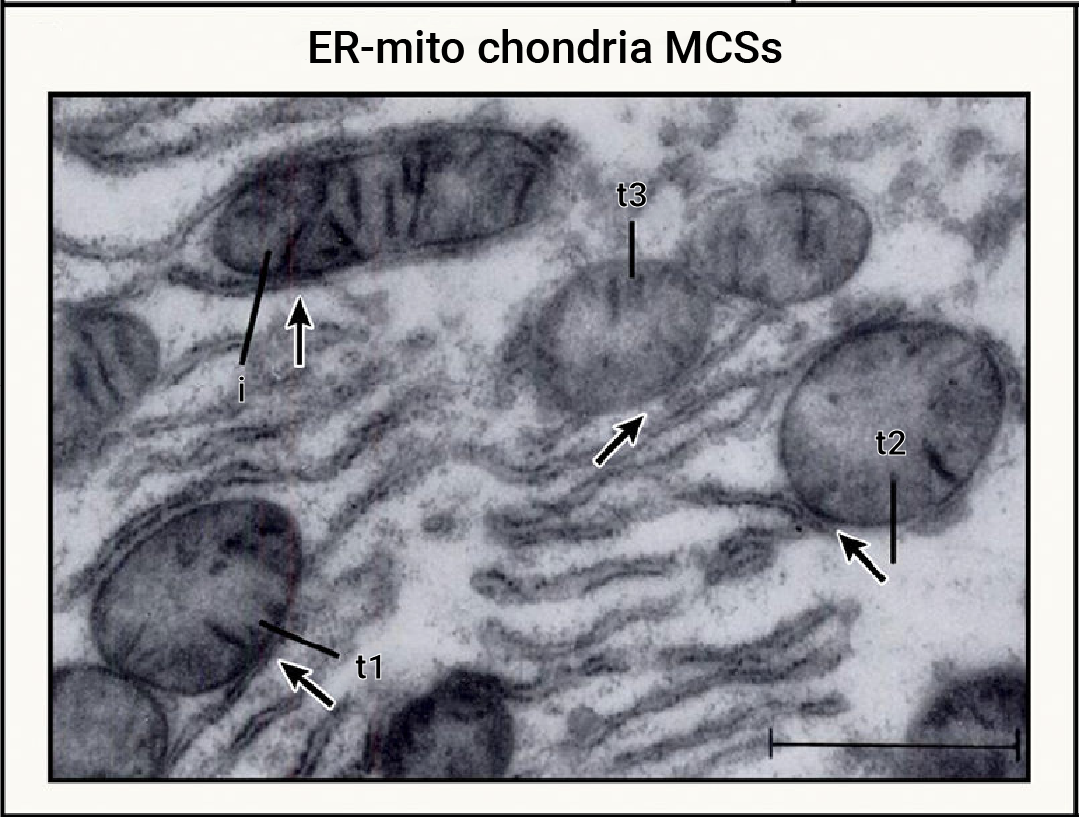 图 5. 大鼠肝细胞中存在丰富的内质网-线粒体接触位点[2]。 MAM 是对细胞生理条件十分敏感的一种高度可变的动态结构,其在动态过程中保持正常的形态结构依赖于某些作为物理连接的蛋白质分子,主要包括钙离子通道 IP3 受体 (IP3R)、分子伴侣葡萄糖调节蛋白 75 (Grp75)、内质网-线粒体相遇结构复合体 (Endoplasmic reticulum mitochondria encounter structure,ERMES) 以及线粒体融合蛋白 2 (MFN2) 等。此外, MAM 内还含有其他多种蛋白,与协调 Ca2+ 转移、ROS 的产生、凋亡诱导以及脂质代谢相关 (图 6)。 除了线粒体,内质网与作为分泌途径中央分选和加工站的高尔基体、以及在细胞内吞、胞吐和自噬作用等过程中发挥重要作用的溶酶体也存在相互作用 (图 6)。 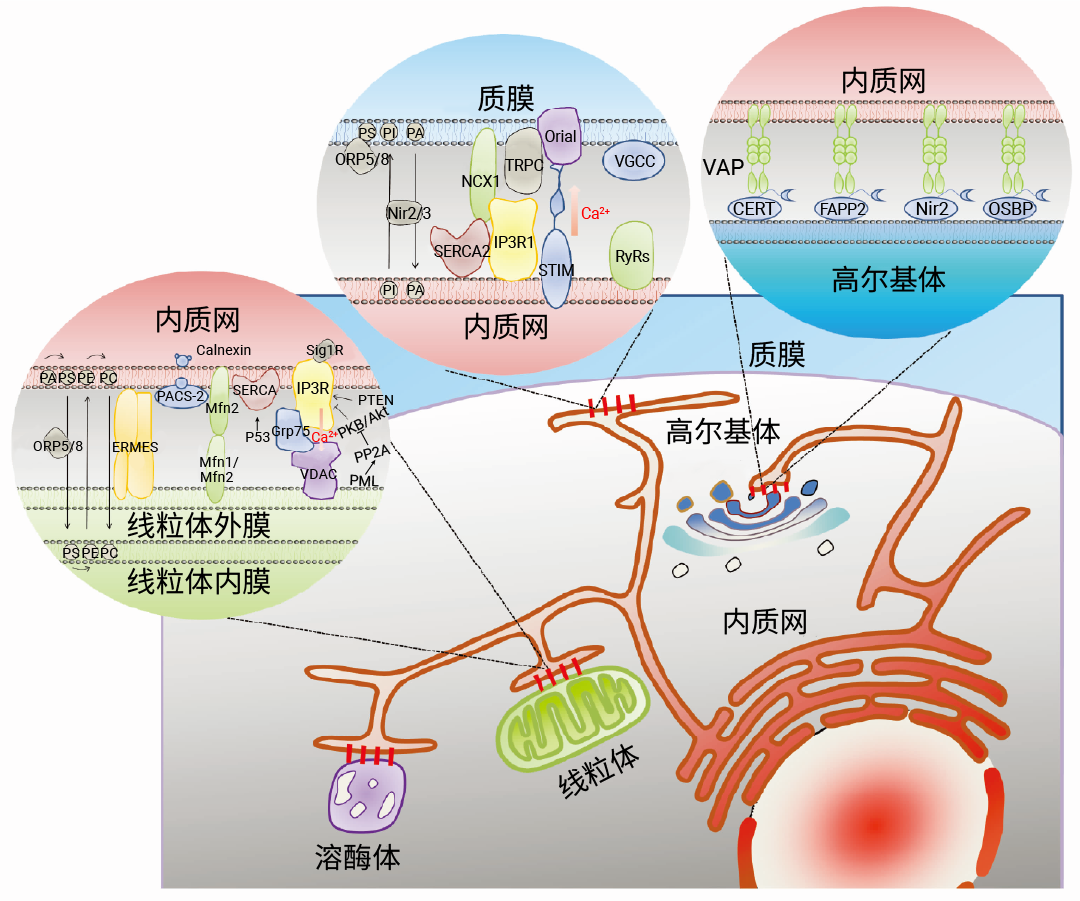 图 6. 内质网-细胞器膜接触位点 (MCSs) 蛋白分子机制图[5]。 表 1. 内质网-细胞器 MCSs 蛋白的特点、功能及相关疾病[5]。 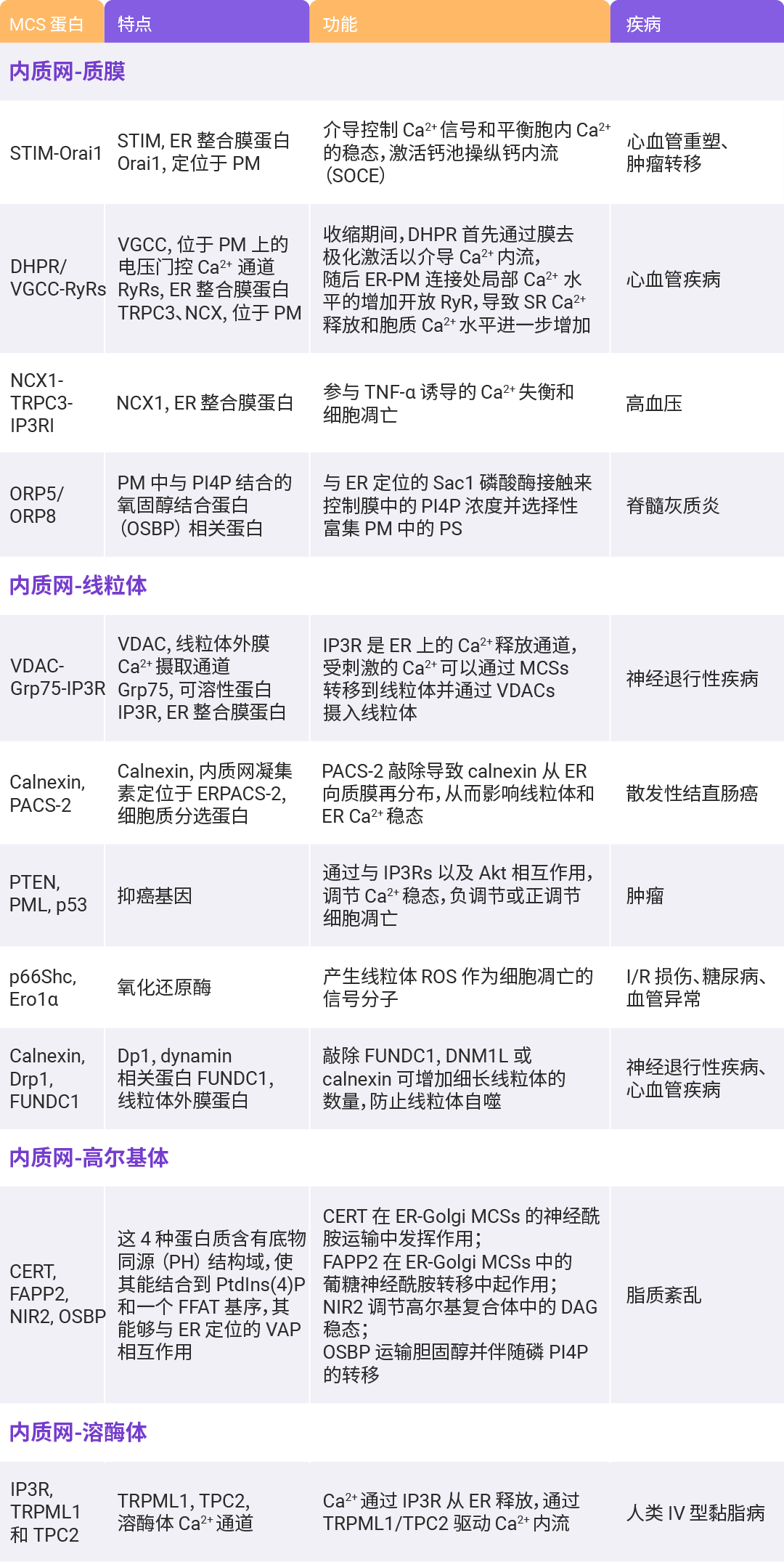
超高分辨荧光成像实验还揭示了内质网对线粒体的形态构造的调控作用,线粒体与内质网接触区域表现出明确的收缩,为后续线粒体的分裂铺垫[6]。 图 7. A. 线粒体 (绿色) 和内质网 (洋红色) 的接触;B. 仅线粒体绿色通道。白色箭头指示线粒体和内质网接触位点的线粒体收缩和分裂[6]。 线粒体-溶酶体 线粒体和溶酶体调控着众多生物学过程,这些过程对于维持营养和代谢稳态以及细胞整体活力至关重要。研究表明,与之前研究过的其他细胞器类似,线粒体和溶酶体也会通过特殊的膜接触位点 (MCS) 进行通讯,这些位点被称为线粒体-溶酶体接触(Mitochondria-lysosome contacts,MLC),它们促进彼此间的动态相互作用,而无需膜融合。 通过 MLC 进行的信号整合参与了关键过程,包括线粒体的分裂和动态变化,以及钙、胆固醇和氨基酸的交换。 图 8. 在出芽酵母中,线粒体 (M) 与溶酶体等效液泡 (v) 形成 MCS[2]。 此外,线粒体-溶酶体相互作用功能障碍也会导致疾病发生。线粒体和溶酶体的相互作用是控制线粒体质量的重要环节。当自噬过程受阻时,胞内能量转化失衡,ROS 含量上升,细胞受到严重的氧化应激刺激导致死亡,该过程发生在神经元细胞中导致神经退行性疾病如 AD、PD 的发生,发生在胰岛 β 细胞中则会影响胰岛素分泌导致肥胖及胰岛素抵抗。 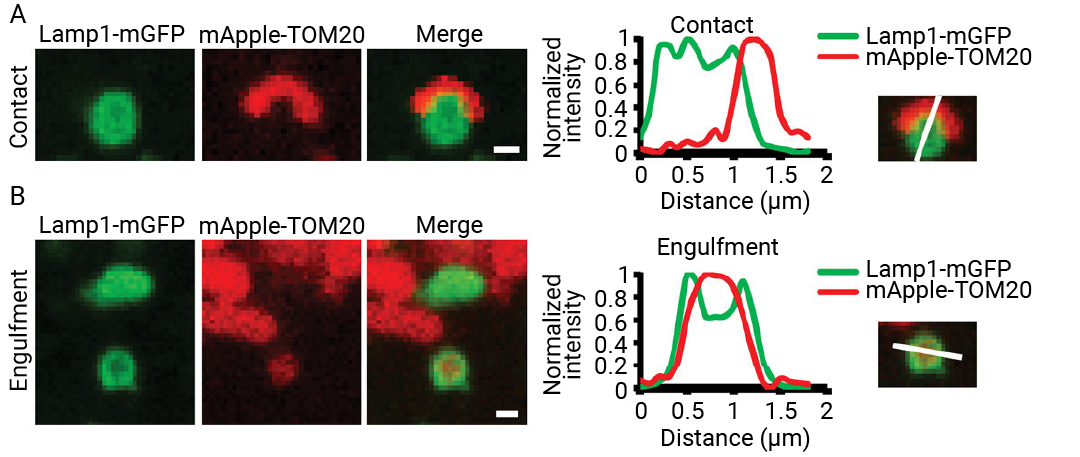 图 9.表达 LAMP1-mGFP (溶酶体) 和 mApple-TOM20 (外部线粒体外膜) 的活体 HeLa 细胞内溶酶体-线粒体互作的表征[7]。 A.溶酶体-线粒体近距离接触;B.溶酶体吞噬线粒体。
Section.03 细胞器互作的表征 细胞器互作短暂迅速且相当微观,即使知道其存在,想要实现表征也并不容易,下面我们通过图像和表格来对比以下几种主流方式的优缺点。 表 2. 表征细胞器互作的实验方法、图示及其优缺点。 案例实操 下面让我们来看一例 MCE 产品标记细胞器的文献实操。Su 等人报道了短链酰基-COA 脱氢酶 (short-chain acyl-CoA dehydrogenase, SCAD) 通过乙酰辅酶 A 依赖的脂噬通路加速衰老相关的肝脏脂肪变性,文中使用 BODIPY 493/503 (HY‐W090090) 和 LysoTracker Red (HY‐D1300) 分别对 HepG2 细胞中的脂滴和溶酶体进行标记和共定位分析。 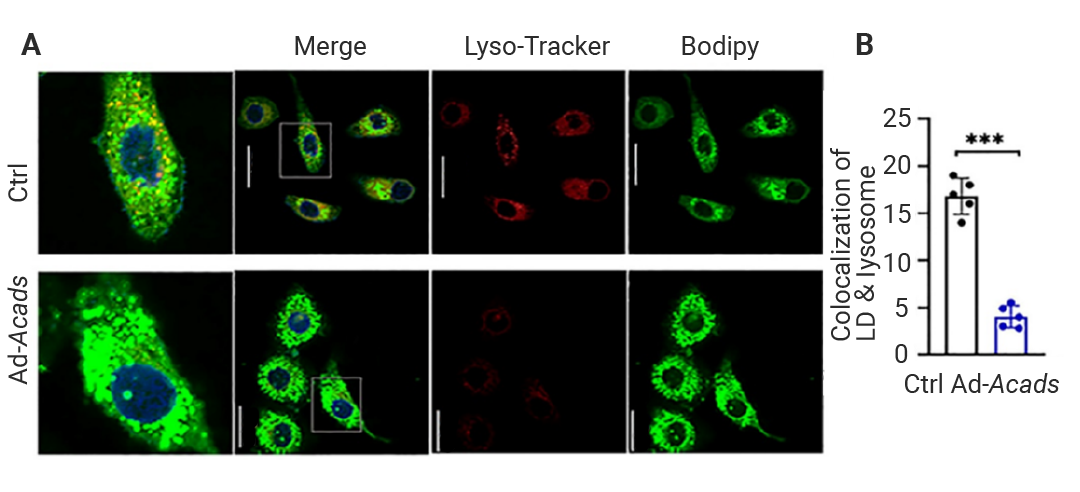 图 10. AD-Acds 大幅减弱了脂滴与溶酶体的共定位[9]。 A.LysoTracker Red 标记溶酶体与 BODIPY 493/503 标记脂滴的共定位荧光图像;B.LysoTracker Red 标记溶酶体与 BODIPY 493/503 标记脂滴的共定位定量分析。
MCE 提供各类细胞器荧光标记染料,可以满足对不同细胞器的多通道染色需求,助力您的研究。
Section.04 小结 随着细胞器互作的研究深入,相信会有越来越多的 MCSs 会被发现,通过对疾病状态下 MCSs 介导的细胞器互作变化的研究,可以进步深入的阐明疾病发生发展的机制,发现相关的调控靶点,对于新药开发、临床治疗和预防有重要意义。
 [1] Hsu, Victor W et al. The evolving understanding of COPI vesicle formation. Nat Rev Mol Cell Biol. 2009 May;10(5):360-4. [2] Voeltz, G K et al. Making the connection: How membrane contact sites have changed our view of organelle biology. Cell. 2024 Jan 18;187(2):257-270. [3] Wozny, Michael R et al. In situ architecture of the ER-mitochondria encounter structure. Nature. 2023 Jun;618(7963):188-192. [4] Shai, Nadav et al. Systematic mapping of contact sites reveals tethers and a function for the peroxisome-mitochondria contact. Nat Commun. 2018 May 2;9(1):1761. [5] 黄淑贞,王广基,谢媛.细胞器互作分子机制及其在疾病发生发展中的作用[J].中国药科大学学报, 2019, 50(4):8. [6] Guo, Yuting et al. Visualizing Intracellular Organelle and Cytoskeletal Interactions at Nanoscale Resolution on Millisecond Timescales. Cell. 2018 Nov 15;175(5):1430-1442.e17. [7] Wong, Yvette C et al. Mitochondria-lysosome contacts regulate mitochondrial fission via RAB7 GTP hydrolysis. Nature. 2018 Feb 15;554(7692):382-386. [8] Weigel, Aubrey V et al. ER-to-Golgi protein delivery through an interwoven, tubular network extending from ER. Cell. 2021 Apr 29;184(9):2412-2429.e16. [9] Deng, Dan et al. Aging-induced short-chain acyl-CoA dehydrogenase promotes age-related hepatic steatosis by suppressing lipophagy. Aging Cell. 2024 Oct;23(10):e14256.
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033