欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
脂质纳米颗粒LNP(Lipid Nanoparticle)(www.medchemexpress.cn/topics/lipid-nanoparticle.html)是一种由脂质类物质组成的纳米粒子,具有均匀脂质核心,广泛用于小分子和核酸药物的递送。
一个典型的 LNP 包含包载内容(payload)及构成递送载体的基本脂质成分。基本脂质成分由可电离脂质(ionizable lipids)、PEG 脂质(PEGylated lipids,聚乙二醇化脂质)、磷脂(phospholipid)以及胆固醇(cholesterol)四种组分构成(图 1)。
图 1. 脂质纳米颗粒基本组成[1] 可电离脂质可电离脂质具有 pH 敏感性,是实现内涵体逃逸、释放包载 mRNA 的关键“钥匙”。同时,可电离脂质可以中和 mRNA 电荷以此增加纳米颗粒的生物相容性,以及有助于防止阴离子生物分子的非特异性结合[2]。
磷脂磷脂可以自发组装形成脂质双层,其较高的相变温度有助于增加 LNP 制剂的膜稳定性和刚性,从而防止内容物泄漏并提高制剂稳定性[3]。
胆固醇胆固醇是细胞膜的天然组分,主要存在于 LNP 的外壳中,通常是 LNP 制剂的结构脂质。其在辅助可电离脂质实现高效内体逃逸的过程中起到重要的优化作用,因此对胆固醇的结构修饰可以诱导 LNP 表面组织的变化[4]。
PEG 脂质PEG 脂质的结构包含亲水头部和疏水尾部,根据聚合程度不同有着不同的分子量范围。 PEG 脂质为 LNP 提供外部聚合物层以阻碍血清蛋白和吞噬细胞系统的吸附,从而延长体内循环时间[5]。此外,PEG 脂质还可被用于设计 LNP 的表面官能化,使得 LNP 能够与配体或者生物大分子缀合,比如使用 DSPE-PEG-Mal 脂质构成 LNP 纳米颗粒,通过马来酰亚胺偶联抗体,实现主动靶向[6]。 表 1. 常见的 LNP 脂质成分及其功能| 组成成分 | 特点 | 功能 | 化合物举例 | Ionizable lipid
可电离脂质 | pH 敏感性:
在低于脂质酸解离常数(pKa)的 pH(<6.0)条件下带正电荷,游离胺随着 pH 值降低而被质子化。 当 pH 值变回生理条件(pH~7.4)时,可电离脂质的电荷变弱或变成中性 | 增加纳米颗粒的生物相容性
介导内涵体逃逸
增加 mRNA 的包封效率 | ALC-0315(HY-138170)(www.medchemexpress.cn/alc-0315.html)
D-Lin-MC3-DMA(HY-112251)(www.medchemexpress.cn/D-Lin-MC3-DMA.html)
Lipid 5(HY-138171) | Phospholipid
磷脂 | 可以自发组装形成脂质双层,是细胞膜的主要成分 | 构成 LNP 的脂质双分子层骨架
增加 LNP 的稳定性和刚性 | DSPC(HY-W040193)(www.medchemexpress.cn/1-2-distearoyl-sn-glycero-3-phosphorylcholine.html)
DOPG(HY-141571)(www.medchemexpress.cn/dopg-sodium.html) | Cholesterol
胆固醇 | 细胞膜的天然组分,两亲性分子 | 调节膜流动性,增强 LNP 的稳定性和完整性
辅助介导内涵体逃逸 | Cholesterol(HY-N0322)(www.medchemexpress.cn/Cholesterol.html) | PEGylated lipid
聚乙二醇脂质 | PEG 脂质的结构包含亲水头部和疏水尾部,根据聚合度不同有不同的分子量范围(400Da-50KDa)。PEG 的摩尔百分比和分子量大小会影响 LNP 的尺寸和电位。大摩尔质量(20KDa-50KDa)的 PEG 应用于低摩尔质量的药物递送中,避免快速的肾脏清除;较低摩尔质量的 PEG(1KDa-5KDa)常用于偶联分子量较大的药物,以减少酶降解 | 控制 LNP 粒径表面官能化
抑制颗粒聚集和血清蛋白吸附
延长体内循环时间 | DSPE-PEG2000(HY-142979)(www.medchemexpress.cn/dspe-peg-2000.html)
DSPE-PEG2000-Mal(HY-144004)(www.medchemexpress.cn/dspe-peg2000-mal-ammonium.html)
DSPE-PEG2000-Amine(HY-125924)
DSPE-PEG2000-iRGD(HY-172494)(www.medchemexpress.cn/dspe-peg2000-irgd.html)
DSPE-PEG2000-T7(HY-172723)(www.medchemexpress.cn/dspe-peg2000-t7.html)
DSPE-PEG5000-RVG29(HY-172706)(www.medchemexpress.cn/dspe-peg5000-rvg29.html) |
LNP 递送系统的作用机制首先,LNP 中的可电离脂质在制备环境下与带负电荷的 mRNA 分子静电络合,形成稳定的复合体。当复合体到达细胞膜时,通过细胞内吞作用进入细胞,被包裹在内体中。内体内部的 pH 值逐渐降低(酸化),导致其中的可电离脂质发生质子化而带正电,带正电的脂质与内体膜相互作用,介导介导内涵体膜破裂或融合(内涵体逃逸),释放所载的 mRNA 到细胞质中。释放的 mRNA 按照生物学的“中心法则”与核糖体结合,表达蛋白质,从而触发免疫应答,预防疾病。
图 2. LNP 携带的 mRNA 疫苗进入细胞,并且释放 mRNA 指导蛋白合成的示意图[7] 脂质纳米颗粒递送系统的优势- 低免疫原性、具有良好的生物相容性和安全性
- 稳定性强,能有效保护包封物
- 核酸包封率高
- 细胞穿透性强、转染效率高
- 内体逃逸能力强
脂质纳米颗粒的制备及表征LNP 的制备LNP 的制备依赖于自组装的能力,带负电荷的核酸和带正电荷的脂质之间产生静电络合,LNP 通过脂质组分之间的疏水作用和范德华作用协同地自组装成一个完整的、包裹着 mRNA 的核壳结构。 LNP 的制备可以通过多种方式进行,例如脂质囊泡的挤出、脂质膜的再水化、纳米沉淀、微流体混合,一般的制备方式是将水和脂质成分快速混合。mRNA–LNP的制备有三种常用的方法可以实现混合脂质溶液和RNA溶液的快速混合:移液管混合法(小规模制备)、涡旋混合法(中等规模制备)和微流体混合法(大规模制备)。此处展示常用的实验室小规模 mRNA–LNP 的制备方案,包括 LNP 制剂制备、mRNA 包载、mRNA–LNP 制备的详细实验方法,可以根据自己的实验目的进行脂质搭配比例上的调整。
LNP 的表征为了确保 LNP 的质量和有效性,需要对 LNP 进行参数表征,例如尺寸、PDI、电荷、RNA EE。 - Size(平均直径/粒径): 通过动态光散射(DLS)检测。
- PDI(Polydispersity index)多分散指数: 范围 0-1,数值越高表示多分散性越强,数值越小表示粒度越均匀,通过动态光散射(DLS)检测。
- Charge(Zeta Potential)电荷: 对于基于 RNA 的 LNP,通常优选近中性电荷,通过 ζ 电位分析仪测量。
- Morphology(形态): 通过电子显微镜(TEM、Cyro-EM、SEM、AFM 等)检测。
- RNA EE(RNA Encapsulation Efficieney%)RNA 包封效率: 可通过 Ribogreen 测定来测量,先测定 LNP 外的 RNA 浓度,然后使用表面活性剂溶解 LNP 来测量 LNP 内部和外部的总 RNA 浓度,计算公式如下:
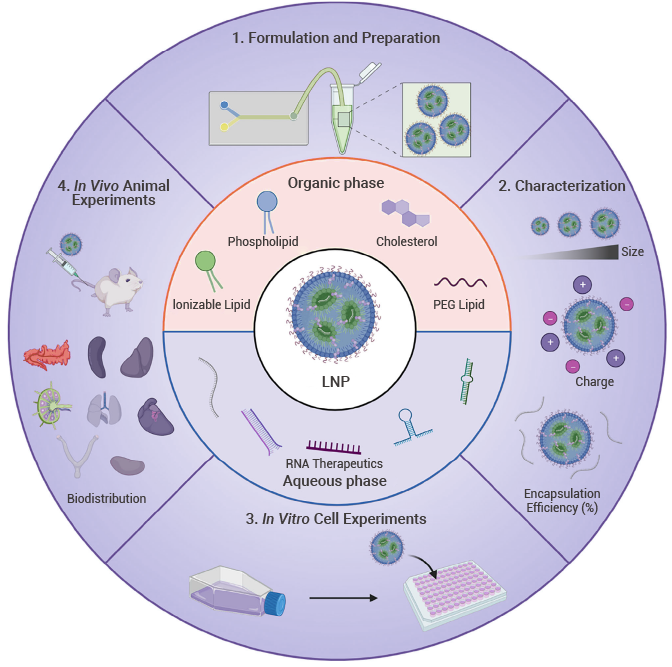 - 图 3. LNP 的表征参数[8] LNP 递送系统的优化进展
尽管 LNP 递送系统具有许多优点,但 LNP 药物递送系统同时也有局限性,例如潜在的细胞毒性、缺乏靶向选择性、循环时间短、内体逃逸差以及需要极端储存条件(例如冷冻)。 针对 LNP 递送系统的改造主要集中在优化各组分和引入新型功能性脂质以提高递送安全性和靶向性。例如利用海藻糖脂替代 LNP 制剂中的部分可电离脂质,所得到的新型 LNP 不仅可有效迁移至淋巴结和脾脏,且可以在保持 mRNA 疫苗有效性的同时,显著降低其毒性(特别是心脏和肝脏毒性)[9]。例如将胆固醇修饰的 DP7 与脂质体递送系统结合,实现对树突状细胞的靶向递送(图 4)。又比如使用 DSPE-PEG-Mal 脂质构成 LNP 纳米颗粒,通过马来酰亚胺偶联抗体,实现靶向组织、器官或细胞。 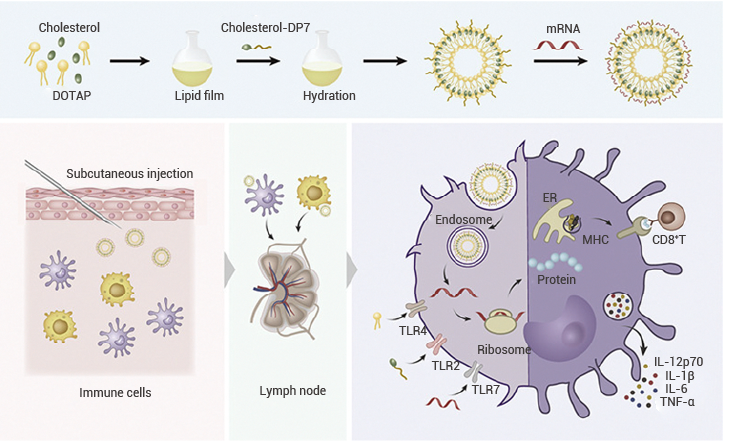 - 图 4. 将胆固醇修饰的 DP7 掺入脂质体递送系统中,使 mRNA 能够有效递送至树突状细胞[10]
随着纳米技术的不断发展,LNP 技术的应用场景也将继续拓展。从基因治疗到疫苗研究,LNP 正在成为生命科学领域的重要工具。未来,LNP 技术将帮助我们继续攻克更多科学难题,迎接一个更加精准、高效的科研时代。 表 2. 靶向递送 LNP 产品| 货号 | 品名 | 特点 | | HY-W441009A | DSPE-PEG-Maleimide ammonium, MW 3400 | -Mal 可用于后续抗体偶联 | | HY-144009 | DSPE-PEG-Folate, MW 3350(https://www.medchemexpress.cn/dspe-peg-folate.html) | -Folate 具有靶向作用能与癌细胞中叶酸受体结合 | | HY-143702 | Fluorescent DOTAP | 荧光修饰可用于纳米载体追踪 | | HY-172494 | DSPE-PEG2000-iRGD(https://www.medchemexpress.cn/dspe-peg2000-irgd.html) | iRGD 可与 av-整合素结合,起到肿瘤穿透的效果 | | HY-172705 | DSPE-PEG2000-RVG29(https://www.medchemexpress.cn/dspe-peg2000-rvg29.html) | RVG29 可以与血脑屏障(BBB)处的烟碱乙酰胆碱受体特异性结合 | | HY-172723 | DSPE-PEG2000-T7(https://www.medchemexpress.cn/dspe-peg2000-t7.html) | T7 特异性结合 TfR | | HY-172464 | DSPE-PEG2000-cRGD(https://www.medchemexpress.cn/dspe-peg2000-crgd.html) | cRGD 肽可以特异性地结合许多癌细胞和新生血管细胞表面的 αvβ3 | | HY-172470 | DSPE-PEG2000-GE11(https://www.medchemexpress.cn/dspe-peg2000-ge11.html) | GE11 可用于 EGFR 过表达的癌细胞 | | HY-172273A | DSPE-PEG2000-M2pep(https://www.medchemexpress.cn/dspe-peg2000-m2pep.html) | M2 极化巨噬细胞靶向肽 | | HY-172277A | DSPE-PEG2000-R9(https://www.medchemexpress.cn/dspe-peg2000-r9.html) | R9细胞穿膜肽 | | HY-K2023 | OptiLNP RNA 转染试剂(局部作用)(https://www.medchemexpress.cn/inhibitor-kit/in-vivo-optilnp-rna-transfection-reagent-local-effect.html) | 局部作用 | | HY-K2024 | OptiLNP RNA 转染试剂(肝脏靶向) | 特异性肝脏靶向递送 | | HY-K2025 | OptiLNP RNA 转染试剂(肺部靶向) | 特异性肺部靶向递送 |
参考文献:
[1] Jung HN, et al. Lipid nanoparticles for delivery of RNA therapeutics: Current status and the role of in vivo imaging. Theranostics. 2022 Oct 24;12(17):7509-7531.
[2] Kowalski PS,et al. Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery. Mol Ther. 2019 Apr 10;27(4):710-728.
[3] Jung HN,et al. Lipid nanoparticles for delivery of RNA therapeutics: Current status and the role of in vivo imaging. Theranostics. 2022 Oct 24;12(17):7509-7531.
[4] Sebastiani F, et al.Apolipoprotein E Binding Drives Structural and Compositional Rearrangement of mRNA-Containing Lipid Nanoparticles. ACS Nano. 2021 Apr 27;15(4):6709-6722.
[5] Eygeris Y,et al. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022 Jan 4;55(1):2-12.
[6] Parhiz H,et al. PECAM-1 directed re-targeting of exogenous mRNA providing two orders of magnitude enhancement of vascular delivery and expression in lungs independent of apolipoprotein E-mediated uptake. J Control Release. 2018 Dec 10;291:106-115.
[7] Aldosari BN,et al. Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics. 2021 Feb 2;13(2):206.
[8] Ma Y,et al. A perspective of lipid nanoparticles for RNA delivery. Exploration (Beijing). 2024 Apr 15;4(6):20230147.
[9] Bae SH,et al. A lipid nanoparticle platform incorporating trehalose glycolipid for exceptional mRNA vaccine safety. Bioact Mater. 2024 May 14;38:486-498.
[10] Liang H,et al. Peptides: potential delivery systems for mRNA. RSC Chem Biol. 2025 Feb 26;6(5):666-677.
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033