欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
2023年2月14日,由耶鲁大学PROTAC先驱者Craig Crews博士创建的公司Halda Therapeutics发布公告,宣布他们将在2.16-2.18日的2023年美国临床肿瘤泌尿生殖学会(ASCO GU)癌症研讨会上首次公开展示RIPTAC疗法的数据。这一疗法有可能颠覆现有的癌症治疗方式。  当前癌症治疗方式大都为对特异性细胞信号通路的研究,并已在肿瘤学领域取得了巨大成功,但如何直接触发癌细胞死亡仍是精准肿瘤学时代生物医学研究面临的药物发现重大挑战之一。 过去的几十年中已经开发了多种选择性触发癌细胞死亡的新方法,如抗体药物偶联物(ADC)、T细胞接合剂 (TCE)疗法和放射性药物,并在临床中已取得成功,但由于无法靶向细胞内蛋白,它们受到靶点数量的限制。最近,蛋白质水解靶向嵌合体(Proteolysis Targeting Chimera, PROTACs)等双功能性小分子为蛋白质接近诱导治疗方式铺平了道路,Halda Therapeutics开发的RIPTAC就是较为有前景的一种疗法。 目前,Halda Therapeutics已融资7600万美元用于开创治疗癌症的新型药物模式——RIPTAC。RIPTAC疗法解决了当前大多数药物模式的一个共同缺陷:依赖肿瘤驱动蛋白导致的耐药性。 简单来说,RIPTAC可提供一种口服的、具有选择性的、可广泛适用的癌细胞杀伤机制,可用于早期癌症和已经出现耐药性的晚期癌症。它通过一种新型的机制起作用,它的一端与肿瘤特异性靶向蛋白的配体结合,另一端与具有基本功能的蛋白质配体结合,由此形成一种稳定的三元复合体。这种蛋白相互作用(PPI)抑制了维持细胞生存蛋白的功能,从而导致癌细胞死亡。 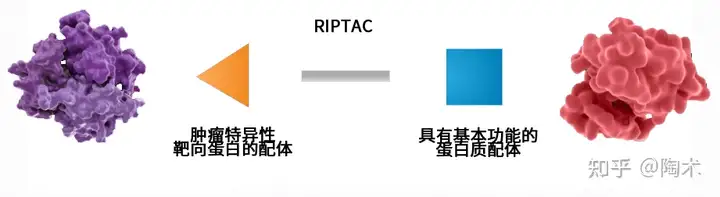 例如,Halda前列腺癌项目靶向的两种蛋白质是雄激素受体(AR)作为肿瘤特异性蛋白质,选择性地将RIPTAC治疗药物传递到肿瘤,以及参与转录调节的一种细胞生存必需的蛋白质。这种疗法在AR和维持细胞生存的蛋白质之间诱导一种前列腺癌特异性蛋白-蛋白相互作用,从而抑制必需蛋白的功能并导致癌细胞死亡。这种新型疗法可以同时克服当前前列腺癌治疗方式的局限性和耐药性。 Crews教授团队也在bioRxiv发文为RIPTAC分子选择性杀伤癌细胞的作用机制提供了概念验证。让我们一起期待后续ASCO GU癌症研讨会上RIPTAC疗法的表现如何吧!
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033