金币
UID24640
帖子
主题
积分18589
注册时间2012-3-30
最后登录1970-1-1
听众
性别保密
|
欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
本帖最后由 kslam 于 2020-1-15 13:41 编辑
美国政府问责局(GAO)在2019年12月10日发布了一份声明, 表明FDA国外检查面临持续的挑战。美国市场60%以上的药品制造商位于海外。GAO一直对FDA监督全球药品供应链的能力感到担忧。 GAO已于2008年建议增加国外检查的数量。 此后,FDA进行了更多此类国外检查。
现在,此新报告基于正在进行的工作,并提供以下信息:
- FDA进行的国外检查数量
- 检查人员配备水平
- 外国检查所特有的挑战
尽管从2012年到2016年,国外药品制造检查的数量有所增加,但此后国内外检查的数量一直在减少。据FDA称,原因之一可能是“调查员的空缺。FDA在美国有190名调查员,他们进行了大多数外国检查,但还有58个职位空缺。但是,也注意到了FDA国外办事处的空缺。
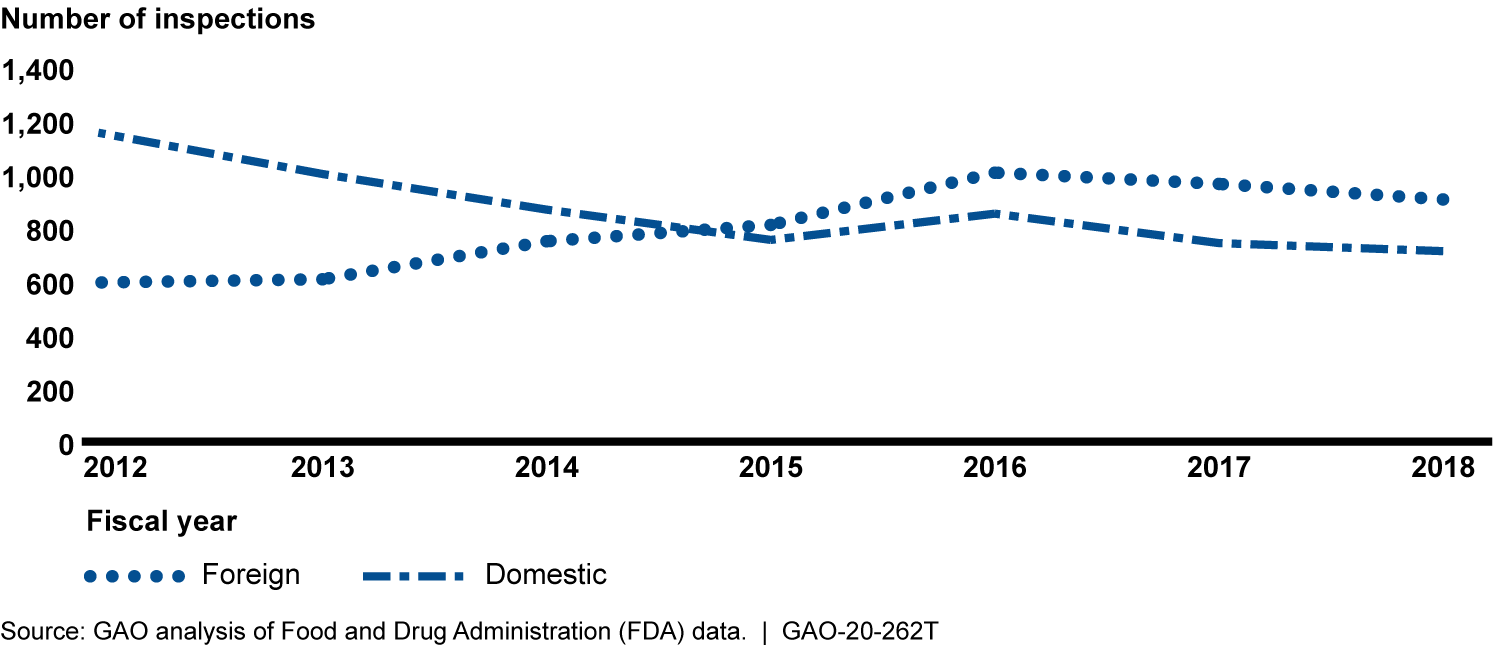
进行国外检查的一个挑战是,在检查日期之前最多十二周宣布这些检查。这可能为制造商提供了解决问题的机会。另一个挑战是翻译人员的必要使用。这有时引起对信息准确性的担忧。
最终得出结论, 外国制药厂仍然是数百万美国人的重要药品来源,而FDA检查是确保这些药品质量的关键工具。 GAO认可FDA为适应全球化带来的变化所做的努力。然而,GAO批评说,FDA在对外国机构的监督中继续面临许多相同的挑战,早在2008年就已确定。
|
|
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033