飞检不合格,多家企业被通报!一家中药企业遭停产
3月3日,国家药监局食品药品核查查验中心发布了一则《医疗器械飞行检查情况通告》。
通告内容显示:依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《药品医疗器械飞行检查办法》《医疗器械生产质量管理规范》及相关附录,以及《食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监〔2015〕218号)等要求,按照国家药品监督管理局2021年医疗器械检查工作部署,核查中心于2021年10月-12月组织开展了医疗器械生产企业飞行检查工作,发现有8家企业存在一般项目不符合《医疗器械生产质量管理规范》及相关附录要求。
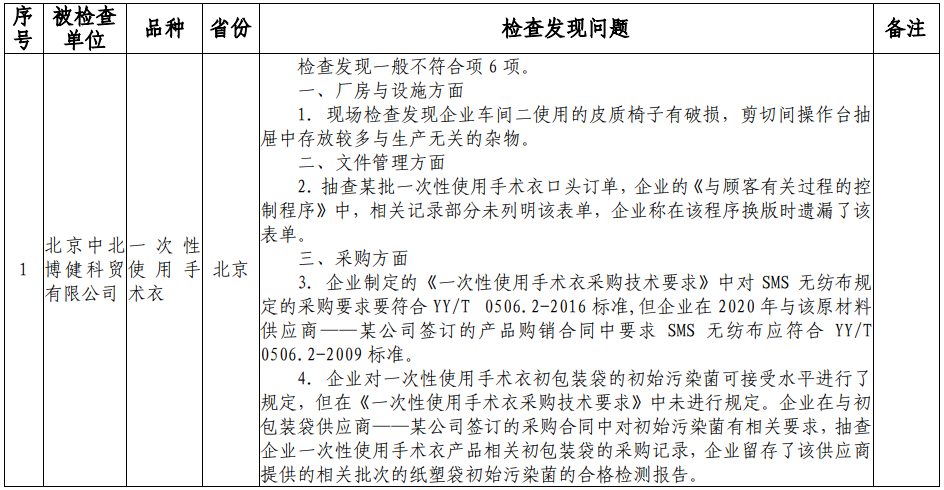
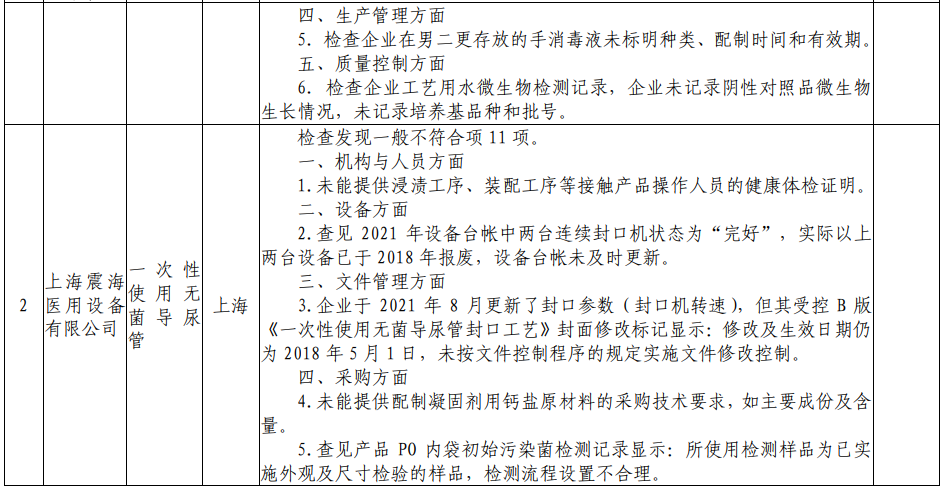
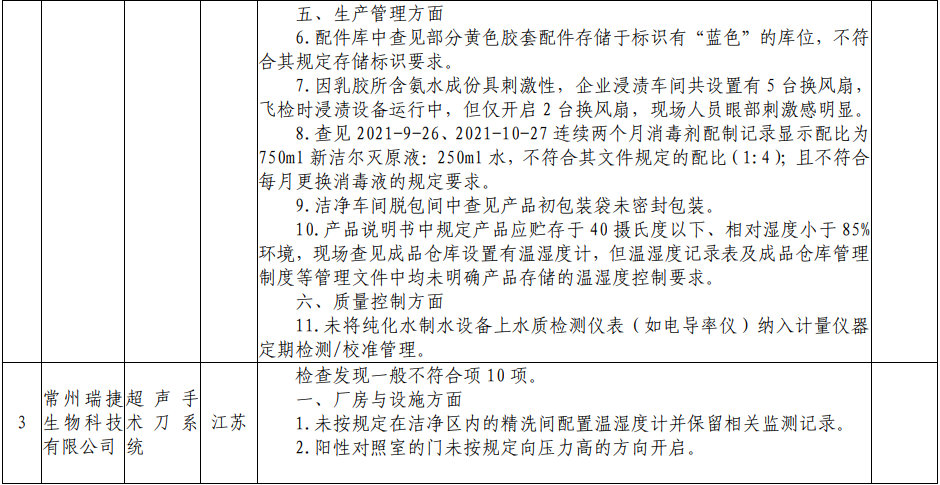
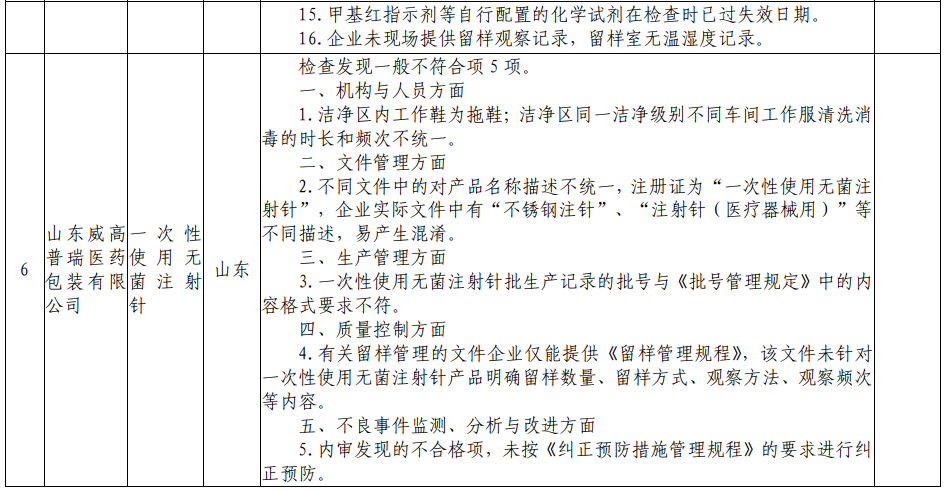
根据核查中心公布的飞检情况来看,北京中北博健科贸有限公司、上海震海医用设备有限公司、常州瑞捷生物科技有限公司、欧普康视科技股份有限公司、南昌市福康医疗器械有限公司、山东威高普瑞医药包装有限公司、深圳市顺美医疗股份有限公司、四川国纳科技有限公司8家医疗器械企业,检查发现一般不符合项目共计63项。本次的飞检品种中,包括一次性使用手术衣、一次性使用无菌导尿管、超声手术刀系统、角膜塑形用硬性透气接触镜等多种医疗器械产品。
值得注意的是,南昌市福康医疗器械有限公司此次被查处不合格项目多达16项,涉及厂房与设施、设备、文件管理、生产管理等方面。除此之外,该企业还被江西省多次查处医疗器械产品不合格的情况,2022年1月份,该企业生产的脱脂棉球存在下沉时间不合格;2021年2月,生产的医用棉签无菌项不符合要求被通报。







针对检查中发现的不符合要求问题,核查中心表示,要求企业按限期整改,评估产品安全风险,对存在安全风险的,应按照《医疗器械召回管理办法》召回相关产品。企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。
飞检不合格,一药企被暂停生产
无独有偶,在同一日,安徽省药监局也发布一则飞行检查结果的通报。
通知内容显示:2022年2月28日至3月1日,安徽省药监局在对亳州广源堂中药饮片有限公司进行飞行检查中,发现该企业存在严重缺陷2项(质量负责人已离职、仓储管理存在较大缺陷),药品存在安全隐患。为此,药监局根据《中华人民共和国药品管理法》第九十九条第三款规定,出立即暂停亳州广源堂中药饮片有限公司中药饮片(含毒性饮片,净制、切制、蒸制、煮制、炒制、炙制、煅制、燀制、制炭)的生产。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/577NKD1_aZwT9XN3YAQO-A)



