成立4年,24款药物资产,9个商业化,毛利基本可覆盖销售费用
当一家创新药公司的CEO,除了产品线和技术之外,开始跟你谈组织力时,大概率可以认为,这家公司已经进入到发展的第二周期:实现自我造血,用自己挣的,而不是投资人的钱,支撑公司运营。
四年可以做成什么?
对欧康维视生物而言,则是从零到现在拥有24条药物管线,9个商业化产品、4万平方米的生产基地、超300人的团队所构建起来的眼科赛道“小巨人”。
4年来,欧康维视生物在一条条撕下产业界在其初创时贴在它的标签:缺少核心产品,那么OT-401获批上市了;产品线来自授权许可,那么第一个自主原创新药OT-202开始临床了;不具备生物制药公司特性,那么生产基地建起来了,销售团队完备了;不能实现自我造血,那么毛利基本可覆盖销售费用的阶段性目标实现了。
欧康维视生物CEO刘晔将实现以上业绩的原因,归结为整个团队的“勇气与光明”,以及因团队凝聚力和执行力而形成的整个公司组织力释放后的节节胜利。“什么带来了勇气和光明?我想是我们整个团队对欧康维视生物正在做的事情的信心,对我们发现的和研发的药物的信心。”
OT-401的获批,恰是欧康维视生物信心、勇气的成果。
01
为行业开新篇章的OT-401
OT-401在欧康维视生物产品线中第一次亮相时,其身份就是“核心产品”。
它也确实撑得起这个“门面”。OT-401原研厂家为美国Eyepoint制药公司,该产品2018年在美国获批上市,是用于治疗眼部慢性非感染性葡萄膜炎的First-in-Class药物,可以持续稳定在眼内释放氟轻松长达36个月,并具缓释和有低剂量眼内给药的特点。据悉,OT-401在美国获批3周后,欧康维视生物即获得该产品的大中华地区开发和商业化权益。
因此OT-401的后续开发,欧康维视生物一直放在首要位置,且产业界与投资者对该产品也寄予厚望。尤其2020年12月,当博鳌乐城真实世界数据研究试点首次纳入药品,而OT-401为其一后,它的研究进展更加备受业界关注。
此前,受益于博鳌乐城真实世界数据研究获批上市的产品,都为医疗器械,且大都来自MNC。产业界都在观望,欧康维视生物的OT-401是否可以在海外已获批新药加速国内上市上,蹚出一条新路。
“有勇气,更有信心”。刘晔至今对制定OT-401奔赴博鳌乐城这一决定的过程记忆犹新。2020年10月,他与欧康维视生物首席医学官陈冬红,去上海锦江饭店拜访一位专家,门口等候的间隙,又讨论起OT-401去博鳌乐城参与先行先试的方案。
刘晔问陈冬红,你有信心吗?陈冬红表示,有信心。说完这些,刘晔当时就表态,有信心,那我们就这么干。
虽然事后,刘晔坦言,作为公司CEO,最主要的工作之一是评估风险,对于当时创建刚一年多的欧康维视生物而言,做这个决定需要莫大的勇气。“那时候政策并不明朗,有不确定性。”但出于对产品和团队的信心,刘晔觉得,这件事情能成。
不负众望,OT-401给希望借助真实世界数据加速上市历程的创新药企开了一个好头,也为欧康维视生物接下来的发展开起了新的序幕。“结果证明,我们当时的决策是正确,正是因为我们提早在博鳌乐城进行了布局,才使得OT-401被纳入到首批药品试点名单中,使用真实世界数据获批上市,比此前规划的商业化进程提早至少半年。”
2022年6月21日,OT-401新药上市申请正式获得NMPA批准,商品名为优施莹。随着优施莹的正式获批,它身上除了欧康维视生物核心产品,国内治疗慢性NIU-PS的潜在best-in-class疗法这两个显性标签外,又增加了NMPA首次受理的以真实世界数据申报的药品、中国本土创新药企第一个完全基于真实世界研究数据加海外对照数据申报上市的新药,两个“亮眼”的描述。
不过,在刘晔眼中,他更看重OT-401给公司后续产品获批上市带来的经验价值,“等于公司凭借该产品,打通了通过真实世界数据上市的路径,为后续产品的推出拉开了序幕。”
02
只求最好的产品线
有近30年医药产业从业经历的刘晔,对目前中国药企创新中产品线布局现状,有一个推断,他认为在研发信息高度透明化、同质化竞争日益加剧的当下,单一产品很难出“爆款”,因此,产品线布局的宽度显得尤为重要,特别是在眼科这类细分领域中。
因此,欧康维视生物创建之初,在产品线布局上就定下两个调子:覆盖所有眼科赛道,并在每个赛道上市同类首个或同类最优的产品,让自己处于领先地位。
4年来,欧康维视生物的产品线一直按此逻辑稳步推进。目前,欧康维视生物对外公布的上市与在研药物资产有24项,几乎覆盖眼后节、眼中节、眼前节所有适应证,而且在很多细分领域有着压倒性的优势。比如在抗过敏领域,有3款已上市产品。“未来,随着欧康维视生物越来越多的新药获批,这样的领域会越来越多。”
比如在眼底病领域,欧康维视生物通过授权许可,已经布局了三个产品,分别是雷珠单抗类似药、阿柏西普类似药和氟轻松玻璃体植入剂。其中雷珠单抗类似药在日本已获批上市,氟轻松玻璃体植入剂已经获得FDA批准上市,欧康维视生物拥有该产品的大中华区、韩国及东南亚11个国家独家商业化权利。
“目前,欧康维视生物是中国眼科药企中,进入III期临床试验数量最多的创新药企之一”,欧康维视生物年报显示,公司共有6款产品已经处于临床III期,包括OT-1001(盐酸西替利嗪滴眼液)、OT-702(阿柏西普生物类似药)、OT-301(一氧化氮与前列腺素合成的新化合物)、OT-101(硫酸阿托品滴眼液)及OT-502(地塞米松植入剂)等,而如今随着OT-703(Iluvien)进入III期临床,这个数字已经增加至7个。
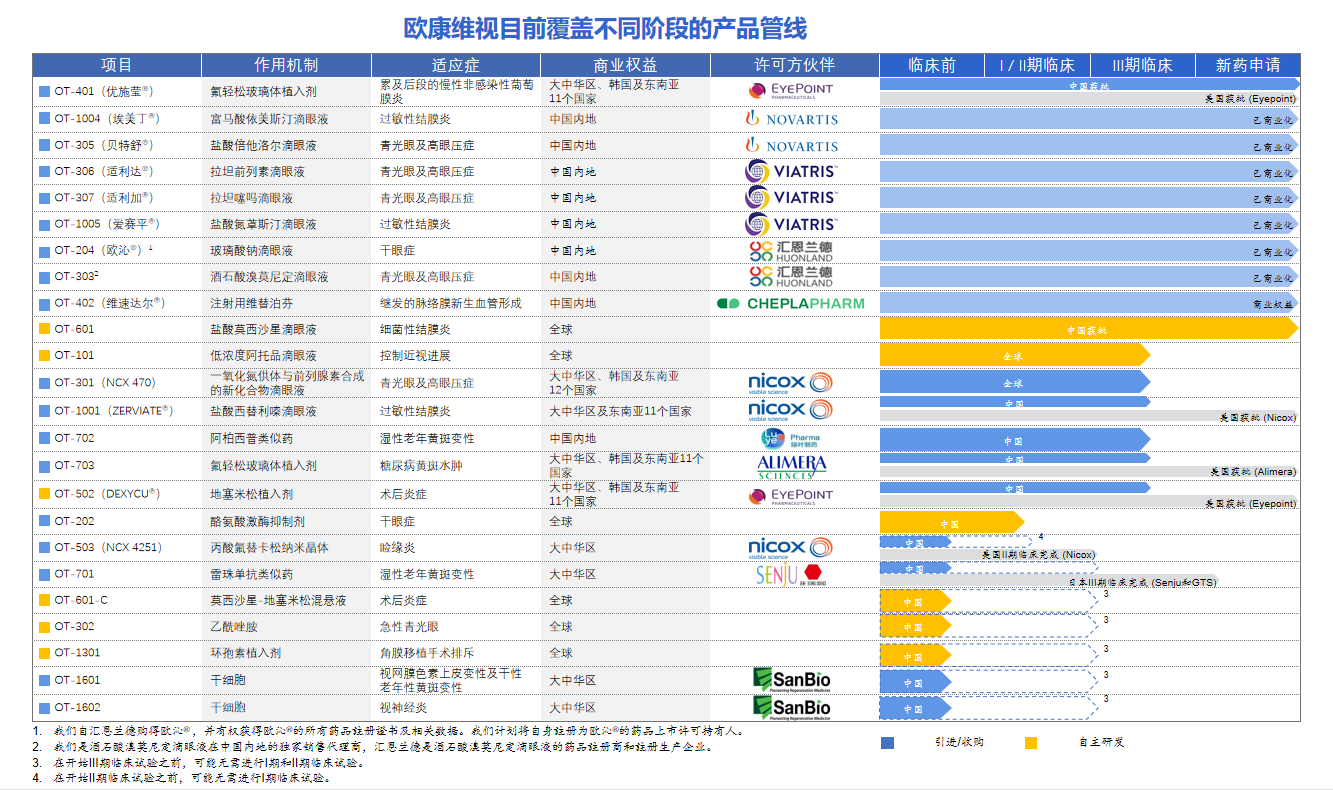
尤其需要提及的是,OT-202(酪氨酸激酶抑制剂)的标志性意义,“该产品获批临床,意味着欧康维视生物开启了创新药引进+自研的双翼驱动新时代。”
OT-202是欧康维视生物自主研发的全新分子实体,其作用机理是通过抑制酪氨酸激酶活性,达到抗炎的作用,用于治疗干眼症,“是中国眼科为数不多的全新靶点创新药。”据悉,OT-202 的I期临床试验已完成所有受试者入组。
03
完成生物制药的蜕变
在中国,几乎所有生物技术公司都有一个“心结”,那就是通过自我造血,实现公司的持续运转。从商业层面而言,就是自有产品的销售额及利润,能够补益后续的研发、生产、市场、销售成本,真正成为一家持续盈利的生物制药公司。4年来,欧康维视生物的运营重心也是如此。
“2020年以前,欧康维视生物是一家生物技术公司。2021开始,我们已经走在向生物制药公司提升的路上”,刘晔认为这种转变,有几个显性指标,“研发、生产、销售、核心产品,这个几个生物制药公司需要具备的要素我们已经齐全”。
生产方面,2021年欧康维视生物坐落于苏州的生产基地已经投产使用,5层总面积达4万平方米的单体建筑,为欧康维视接下来眼科产品的自主生产打下基础。“欧康维视生物规划产能是4.55亿剂,目前已经有两条生产线开始运转,设备采购国际一流的制药装备公司罗姆来格”。欧康维视生物生产负责人刘宏英表示。
值得一提的是,两条罗姆来格的生产线,耗资接近1.5亿元。这笔大投资,在刘晔看来物有所值,“眼睛即脆弱又敏感,因此眼科药物的生产质控要求,肯定要高于一般药品。”
销售方面,过去4年,欧康维视生物的团队建设与产品上市进度相互匹配推进。随着核心产品优施莹的获批上市,刘晔认为欧康维视生物的销售团队建设基本完成,目前共有销售人员150名左右,基本能够覆盖全国等级医院。“我们不搞人海战术,而是看人均产出,可以自豪地说,我们现在的人均销售产出已经达到行业平均水平。”
一个关键性数据是,最近几月随着销售额的快速增长,欧康维视生物的销售毛利已经高于销售费用,这项数据虽然不能证明欧康维视生物已经成为可自我造血的生物制药公司,但这是公司接下来实现盈利的重要节点。“毛利高于销售费用,对欧康维视生物而言,一方面是公司的产品受到了市场和患者的认可;另一方面也公司的销售团队能力的证明。”
接下来,刘晔给到欧康维视生物的目标是真正转型成为一家生物制药公司,他认为转型的成功有两个核心指标,首先是实现盈利,2021年欧康维视已经实现接近亿元的终端销售额,随着核心产品优施莹获批上市,将为这一目标的实现提供加速度。其次是在眼科各适应证从研发的领先到商业化的全面领先,“目前在抗过敏、青光眼、葡萄膜炎、视网膜病变及近视眼等领域,欧康维视生物已经具有竞争优势,接下来我希望这些领域能更多,至少实现5个领域的领先。”
在刘晔看来,这是一个时间到了,自然而然就会实现的目标。他的底气来自4年来,公司在研发、生产、销售体系与能力建设中所凝聚起来的组织力,“生物制药公司的运营复杂性高出生物技术公司,优秀的公司不能依赖某几个天才,而是在良性的公司运营系统下,让每个身处其中的人变得优秀,并集合在一起发挥出最大的效率。”这是过去4年,欧康维视生物取得成功的原因,也是接下来欧康维视生物实现自我蜕变的基础。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/AP-MFcGhwj91kv-cY6ci-g)



