III期临床被迫中止,但不影响申报
近日,专注于眼科的瑞士生物制药公司Oculis关闭了一项核心管线OCS-01的III期临床试验,此前第三方机构的管理失误影响了研究的进行,阻止了对结果的分析。
虽然如此,根据Oculis的说法,FDA方面认为,另一项晚期试验和中期研究的数据足以支持公司在2025年第一季度提交OCS-01的新药上市申请。
OCS-01
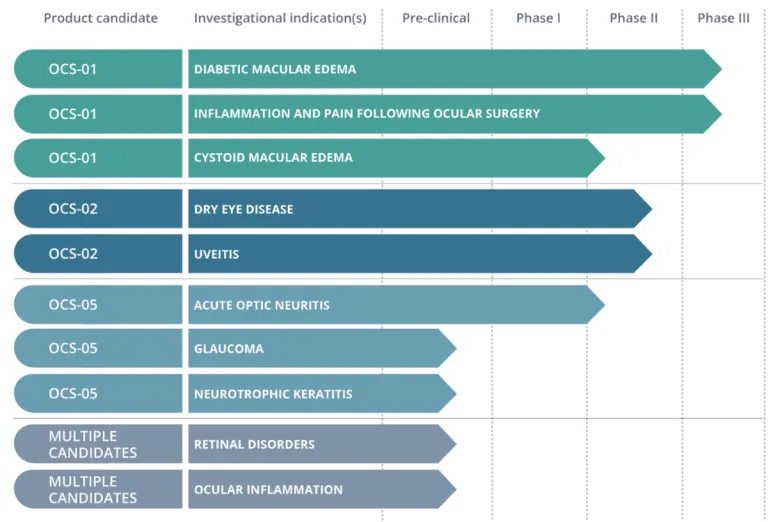
OCS-01是Oculis的核心管线,是一类地塞米松外用滴眼剂,是利用Oculis公司的专有OPTIREACH®技术平台开发的。该技术平台通过提高亲脂性药物的溶解度,增加药物在眼表的停留时间,并促进药物从眼表递送到眼底,从而解决了传统眼药水在眼后节疾病治疗中的局限性。
即将停止的试验是OPTIMIZE-2,该试验一直在测试OCS-01滴眼液在白内障手术后患者中的安全性。试验的主要目标是测量炎症和疼痛。
Oculis在其第二季度财报中没有提供第三方管理错误的细节,但表示本月早些时候已经按计划为OCS-01举行了NDA会议,以寻求与FDA就滴眼液的监管意见达成一致。
在那次会议上,监管机构表示,已完成的眼科手术和DME的III期OPTIMIZE-1试验和II期SKYGGN研究的数据可用于支持其申请上市。
目前Oculis公司除了OCS-01之外,还有用于治疗干眼症的TNF-α单抗OCS-02,以及用于眼神经障碍的SGK2激动剂OCS-05。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/RD4IdSpSBBZnzni19dUb-g)



