阿尔茨海默病迷局:礼来市场准入受阻、罗氏终止合作
阿尔茨海默病作为一种极具挑战性的神经退行性疾病,其治疗开发一直在不断碰壁。尽管科研进展推动了对β-淀粉样蛋白、tau蛋白等病理机制的理解,但转化为有效疗法的道路却充满了波折和不确定性。随着全球老龄化的加速,这一疾病给医疗体系和家庭带来的负担日益严峻,迫切需要新的突破。然而,药物开发的每一个环节不仅是科学探索的漫长旅程,还是制药公司在面对临床试验、监管审查和市场准入等多重挑战下的平衡考验。
在这一背景下,阿尔茨海默病疗法的研发逐渐成为一个充满竞争和变数的战场。科学与商业、技术与政策、希望与挫折,交织成了这场攻坚战的独特格局,背后是企业愿景与市场现实的博弈。在这场漫长的竞赛中,成功并不仅取决于科研的前沿性,更在于对战略选择的深思熟虑和对市场复杂局面的精准把控。阿尔茨海默病疗法的开发,似乎正面临着“东边日出西边雨”的局面。
临门一脚,礼来Donanemab商业化英国受阻
在渤健和卫材将Aduhelm撤市之后,礼来的donanemab成为了市场上最主要的阿尔茨海默病单抗疗法之一。然而donanemab在英国的商业化受到了重大挫折。虽然donanemab已经获得英国药品和保健品监管机构(MHRA)的批准,但近日英国国家卫生与临床优化研究所(NICE)再次对donanemab表示了质疑,认为其疗效有限,成本高昂,无法证明其对纳税人来说具有良好的价值。NICE罗列的理由包括相对较小的效益和高昂的成本,包括药物本身的价格、每月输注的费用以及因药物副作用引发的监测费用,因此暂时不适合在英国国家医疗服务体系(NHS)中使用。
尽管美国已批准donanemab并以Kisunla的商品名销售(价格约为每年32000美元),但英国通常通过谈判降低NHS中提供的药品价格。对此,NICE认为,临床试验数据表明donanemab虽然能延缓阿尔茨海默病进展四到七个月,但其长期效益尚不明确,且其成本效益指数超出NHS通常接受的范围五至六倍。
对于NICE的评估礼来在一份声明中表示,患者在β-淀粉样蛋白水平降至一定程度后可停止使用donanemab,这有助于降低输液次数和相关成本。因此礼来仍对donanemab的临床疗效和成本效益充满信心,并将继续与NICE密切合作,希望在咨询期结束后推动药物进入NHS系统。
NICE的立场是有据可循的。今年8月,NICE也曾在草案中认为渤健和卫材的阿尔茨海默病单抗疗法Leqembi(lecanemab)同样不具备成本效益。虽然Leqembi的关键临床试验证实它们能减缓阿尔茨海默病的早期进展,但专家们仍对它们对患者的实际意义及其高昂的成本和副作用展开了激烈的讨论。
NICE负责评估新药及疗法的临床和经济效益,帮助决定哪些治疗方案应纳入英国国家医疗服务体系(NHS)的覆盖范围。其目的是确保纳税人的资金被有效利用,同时患者能够获得高效且负担得起的治疗。这有些类似于美国PBM (Pharmacy Benifit Manager,药品福利管理者)的角色,但NICE并不参与利益的瓜分。NICE的评估过程主要包括两个方面:临床效益和成本效益。首先,NICE会审查新药在临床试验中的表现,评估其是否能够有效地延长患者的寿命或改善生活质量。这一过程确保药物不仅在技术上可行,还在实际使用中能带来显著的健康收益。其次,NICE还会重点分析药物的成本效益。评估的关键标准是药物的价格是否合理,通常通过衡量每个健康生命年(QALY)的成本来判断。QALY是一个综合指标,反映药物能否为患者延长高质量的生命时间。通常,NICE对 NHS资源的合理使用设定了一个上限,即药物的成本效益必须处于合理范围内,如果某种疗法的费用过高而效益有限,它可能不被推荐纳入NHS 覆盖。
对于 NHS来说,NICE的正面评价通常是药物被列入常规覆盖的前提条件。因此,NICE的评估对患者能否通过NHS 获得某种药物至关重要。这种评估体系确保公共卫生资金的有效使用,同时为患者提供有益的治疗。
半途而废,罗氏终止与USB的合作项目
礼来的挑战出现在商业化的阶段,而有志于进入阿尔茨海默病市场的罗氏则在研发的道路上遭遇挫折。
罗氏日前宣布终止与UCB共同开发阿尔茨海默病候选药物bepranemab的合作,这是罗氏今年第三次放弃阿尔茨海默病项目。早在1月,罗氏就将两项合作开发的阿尔茨海默病资产归还给了AC Immune。
罗氏与UCB于2020年达成的合作原本包括1.2亿美元的预付款和高达20亿美元的潜在里程碑付款。不同于已经上市的lecanemab和donanemab,bepranemab靶向的是tau蛋白,tau蛋白同β-淀粉样蛋白一样被视为阿尔茨海默病的生物标志物。在阿尔茨海默病的诊断和研究中,tau蛋白的水平和磷酸化状态常被用作生物标志物。通过脑脊液(CSF)或血液中的tau蛋白水平,可以评估疾病的进展和严重程度。研究表明,tau蛋白的升高与认知功能的下降密切相关,且在疾病早期就可能检测到其变化。因此,tau蛋白不仅是阿尔茨海默病的关键生物标志物,也是开发新治疗方法的潜在靶点。
然而bepranemab的IIa期临床试验结果却令罗氏兴致阑珊,最终决定将该药物的开发权交还给UCB。尽管罗氏在其2024年第一季度的财报中曾表示,预计bepranemab将于2027年或更晚提交监管申请,但在随后的第二季度财报中却未提及bepranemab,这已经显出了罗氏准备偃旗息鼓的迹象。
罗氏在阿尔茨海默病药物开发方面可谓命运多舛。其早期的候选药物gantenerumab在2022年未能通过两项III期临床试验,导致罗氏在阿尔茨海默病领域的万丈雄心遭遇重大挫折。但面对一系列挫折,罗氏依然矢志不渝,仍在积极其他阿尔茨海默病资产,如RG6289和trontinemab(RG6102)。后者在早期临床试验中显示出对淀粉样蛋白斑块的显著清除效果。
在被罗氏“抛弃”之后,UCB表示将在获得外部专家的反馈后评估bepranemab未来的发展方向。Bepranemab是一种靶向tau蛋白中重要区域的单克隆抗体,可能干扰病理性聚集tau蛋白的细胞传播。UCB相信,bepranemab的独特的作用机制存在很大的开发价值。Bepranemab结合tau蛋白的中间区而不是N端,这在干预tau传播方面可能比其他抗体更加有效。目前有多种抗tau 蛋白疗法正处于阿尔茨海默病的临床前和临床开发阶段,许多公司将tau靶向药物视为提高β淀粉样蛋白清除抗体的增强剂,也就是产生有利的协同作用,尽管USB和罗氏的协同作用已经走到了终点。
虽然罗氏终止了与UCB的合作, 但他们仍对tau靶向疗法开发保持了浓厚兴趣,终止与USB的合作“非战之罪也”。罗氏仍在试图针对tau 蛋白开发阿尔茨海默病疗法,包括与Sangamo Therapeutics Inc. 建立的临床前合作,两家公司于8 月签署了5000 万美元的预付款。
罗氏:bepranemab已死,trontinemab当立
罗氏之所以这么决绝地放弃bepranemab,在一定程度上是因为他们拥有一款嫡出的阿尔茨海默病管线资产trontinemab。
Trontinemab是由罗氏开发的一种用于阿尔茨海默病单抗药物候选物。它采用罗氏的“脑穿梭(Brainshuttle)”技术,以蛋白质之躯跨越血脑屏障,靶向并抑制β淀粉样蛋白。这种技术允许大分子在不触发对周围细胞的免疫反应的情况下穿过血脑屏障。
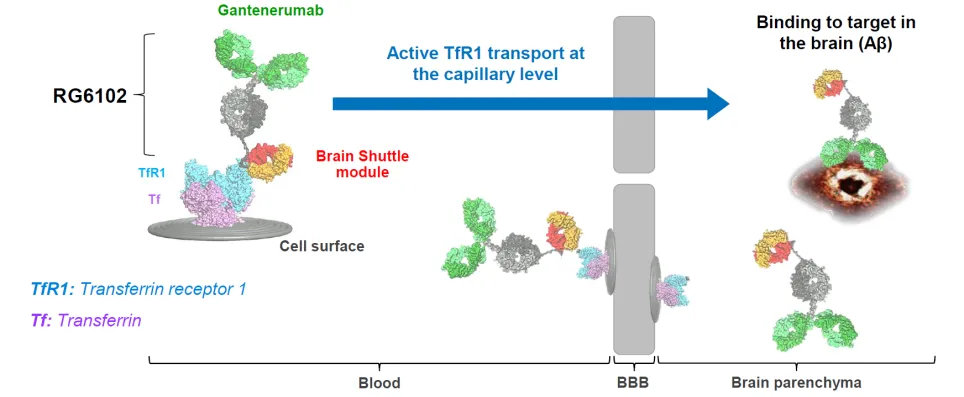
图1. Brainshuttle技术支持的trontinemab穿越血脑屏障机制。(图片来源:Neuron)
Trontinemab(RG6102)是抗淀粉样蛋白单抗gantenerumab 的新版本。与人类转铁蛋白受体结合的Fab 片段附着在gantenerumab的Fc结构域上。在血液中循环的trontinemab会与构成血脑屏障的内皮细胞上的转铁蛋白受体(TfR1)结合,这会导致其内吞并释放到脑实质中(图1)。
在 AD小鼠模型中,与未经修饰的gantenerumab 相比,trontinemab进入大脑并与淀粉样斑块结合的抗体多50倍。Trontinemab可以以远低于gantenerumab的剂量刺激免疫细胞清除斑块,而不会引发对内皮细胞或其他转铁蛋白受体旁观者细胞的免疫反应,这样可以降低潜在的副作用和免疫相关的并发症,而安全性也是阿尔茨海默病单抗开发过程中的重要挑战之一。
在经历了阿尔茨海默疗法开发过程中的重重磨难后,罗氏对于trontinemab的期望可想而知。罗氏CEO Thomas Schinecker表示,尽管遭遇了多次阿尔茨海默病的挫折,但罗氏对trontinema的前景“极为乐观”。罗氏将在近期公布trontinema的最新数据。Schinecker信心满满地说:“我们已经知道trontinema会奏效的,我想说可能性相当高。当然,生活中没有保证。”投资者已经开始对罗氏在阿尔茨海默病疗法开发过程中的屡遭挫折表示出了不满,Schinecker此时对trontinema的高度期待在一定程度上也是针对投资者的这些焦虑做出的。
罗氏第三季度的五大药物销售驱动来自眼科药物Vabysmo、乳腺癌药物Phesgo、多发性硬化症治疗药物Ocrevus、血友病药物Hemlibra 和血癌药物Polivy。这些药物合计带来了46亿瑞士法郎(约合53亿美元)的收入,同比增长21%。但罗氏的支柱产品肿瘤学药物Tecentriq可能已经达到销售峰值,将逐步面临衰退,在这种情况下,罗氏对于阿尔茨海默病疗法的“十年面部图破壁”的期待将更加强烈。
总结
阿尔茨海默病治疗的开发过程正面临着多重挑战,这一局面在礼来与罗氏的战略举措中得到了体现。
礼来的donanemab在英国的商业化进展遭遇障碍,阿尔茨海默病疗法在完全不同于美国市场的情况下,除非具有相当确定的成本效益,否则将在市场准入方面遭遇巨大挑战。
与此同时,罗氏宣布终止与USB的合作项目,这也显示了在Leqembi和Donanemab上市并且未取得众口铄金的局面下,后来者将感受到来自于临床数据的巨大压力。
这一系列事件都揭示了阿尔茨海默病疗法开发的复杂局面。在这个存在着巨大未满足的领域,药物开发很容易陷入“尔曹身与名俱灭”的境地。除了令人信服的临床数据之外,市场对疗法的接受度、定价策略及支付方的支持也直接影响到药物的成功推出。虽然这一规律在医药开发领域几乎放之四海而皆准,但对于阿尔茨海默病来说表现尤甚。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/tM_WUZZHXS58vJTOXftRxg)



