原研未上市,仿制被驳回了20条?
吸入制剂是现今的研发热门:
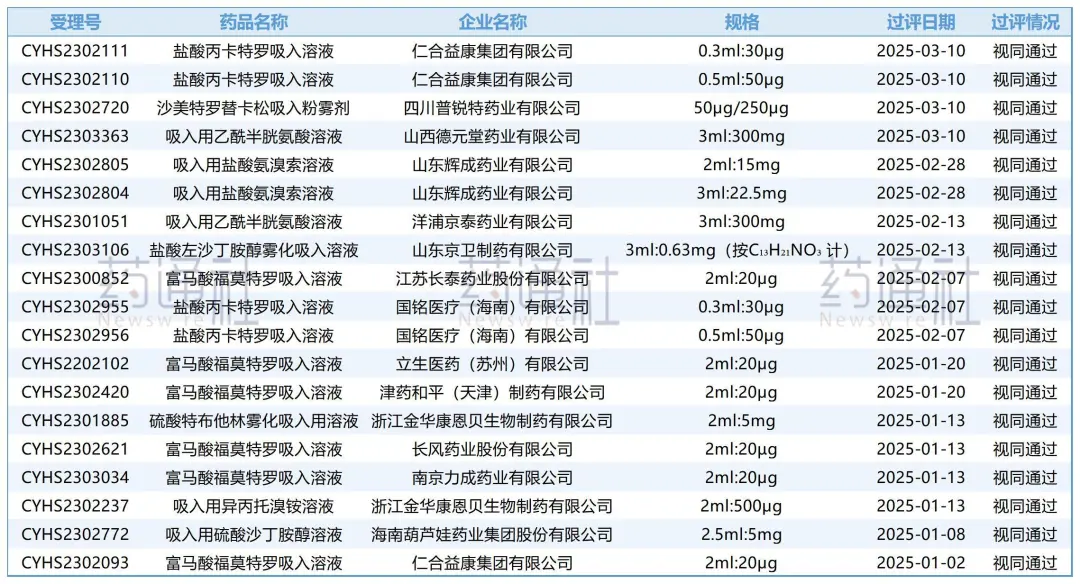
吸入用盐酸氨溴索溶液是通知件上的常客,屡屡被拒。
截止目前,该品种已累计被驳回20条受理号,涉及16家持有人;仅5家过评,过评率低得令人咋舌。
最近的一家是辉成药业2月28日过评。时间上和四川普瑞特仅差一天,结果却截然不同。
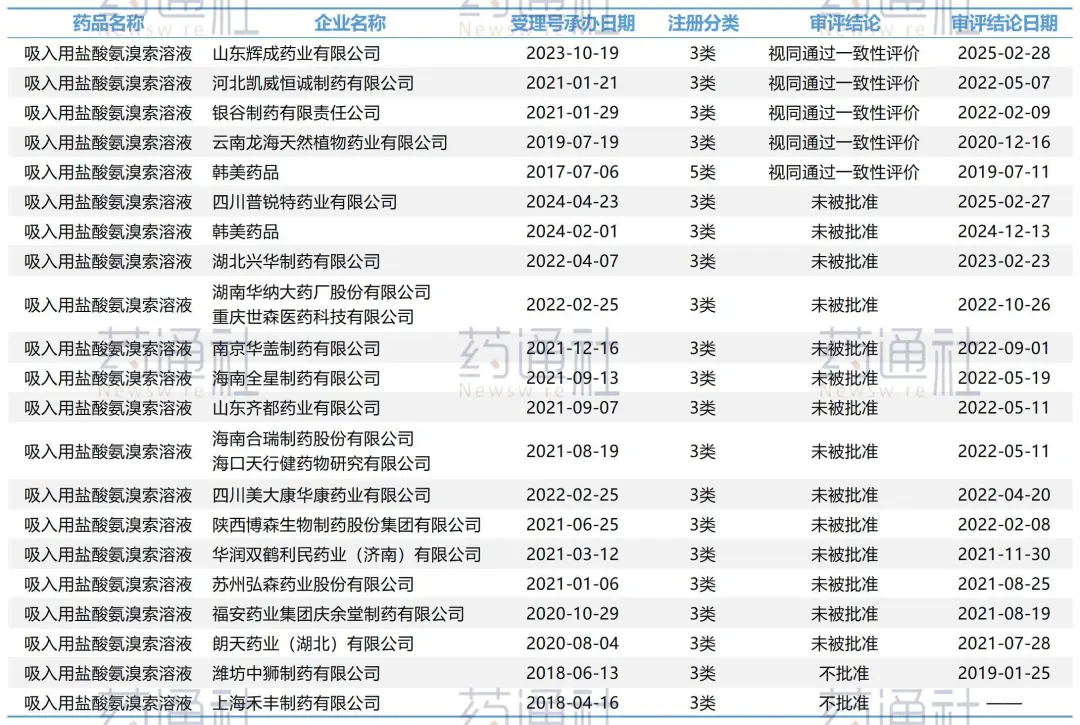
图:吸入用盐酸氨溴索溶液审批情况,图源:摩熵医药
1965年,由勃林格殷格翰公司研制,1978年首次在德国上市。自上市以来,其疗效显著,毒副作用小,可明显提高肺部功能指标,迄今已超过40年的应用历史。
吸入用盐酸氨溴索溶液是该成分的吸入制剂,由勃林格殷格翰公司在欧洲上市(后与Sanofi 合作开发),在欧洲上市多年,国内一直未有上市。
直到2019年,韩国企业韩美药业的产品在国内首家上市,视同通过一致性评价。值得注意的是,由于当时吸入用盐酸氨溴索溶液的参比还未定,韩美药业是以化药5类申报获批。
作为目前市场上最安全有效的祛痰药之一,后续有不少企业参与布局。
但正如上文所说,过评进程一直不太顺利。
02 驳回原因
针对这个品种频繁被驳回,推断原因有二:
其一是参比选择错误。
吸入用盐酸氨溴索溶液曾经有两个参比制剂,持证商分别是Sanofi法国总部和其德国子公司Sanofi-Aventis。

2024年10月31日,国家药品监督管理局(NMPA)公布了首批从参比制剂目录中调出的品种,其中就包括盐酸氨溴索吸入溶液。调出的原因是该产品未能满足中国药典关于吸入制剂的规范,即“吸入液体制剂必须是无菌制剂”,因此被予以调出。
被调出参比目录的是德国子公司产品,企业若一开始就选择了德国子公司产品作为参比制剂,选错参比自然无法顺利过评。
其二是未做临床试验,且临床难度大。
按理说,吸入用真溶液可以豁免临床。但针对这个品种,从目前审评机构的评审结果来推断,想豁免临床上市已经彻底行不通。
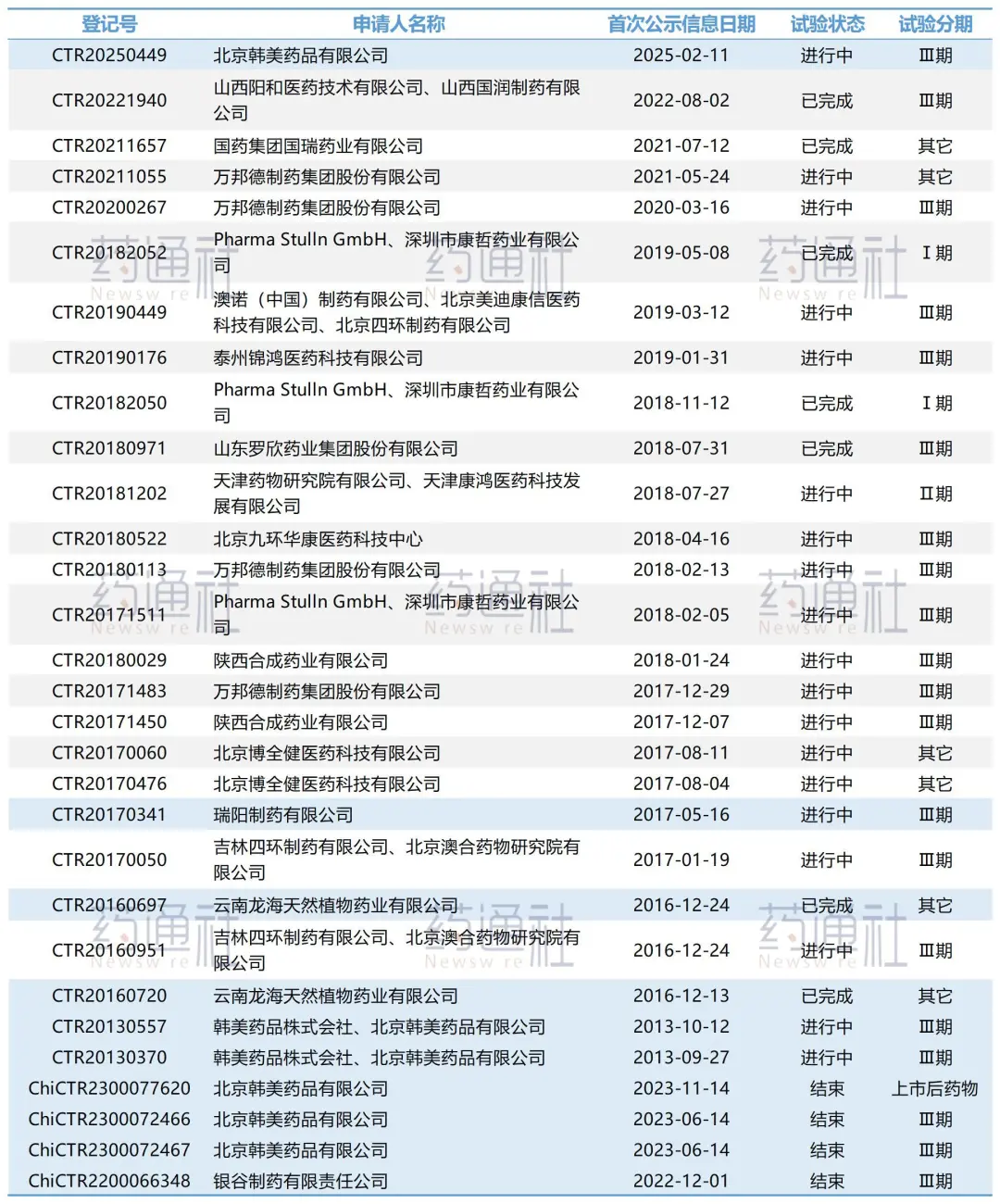
目前已顺利过评的5家企业均能在公开网络查询到临床试验记录;而反之,27号驳回的四川普瑞特和此前多家被驳回的企业均未做临床,也可直接印证。
推测该品种必须做临床的原因大概率是:原研产品国内未上市,临床有效性和安全性还待证实。
因为与之相比,同样是吸入溶液、同样是祛痰类药物,大名鼎鼎的吸入用乙酰半胱氨酸溶液过评之路就非常顺利。
吸入用乙酰半胱氨酸溶液原研2011年上市,随后国内就开始了仿制,产品研发简单且是真溶液可豁免临床,国内过评十分顺利,截止目前已过评26家。
除了必须做临床之外,临床难度大也是可能原因之一。
2019年Sanofi公司产品在国内的参比地位被确立,随即韩美药业便针对确定的参比进行药效一致性研究并按照化药3类进行申报,韩美药业首次在国内上市时已完成了临床安全性及有效性试验,再申报未重新进行临床试验,最终还是被驳回了,直到2025年2月,韩美药业只得再次登记了Ⅲ期临床试验。
由此可见,该品种的临床研究应当不简单,需要好的设计和执行。
简单来讲,因为吸入用真溶液的成分与注射用真溶液极其相似,所以早期临床上非常喜欢把注射用真溶液进行雾化吸入,即呼吸系统疾病治疗中长期普遍存在的超给药途径用药现象。
(注:研究表明注射液与吸入溶液不可互相替代,仅陈述事件非医疗建议。)
早在2000年盐酸氨溴索注射液上市后,医生也很喜欢将其作为化痰药加入雾化机中使用。
所以其实用药习惯本已培养出了。
若吸入用盐酸氨溴索溶液的评审和过评速度跟得上,市场不会小。
只可惜吸入用盐酸氨溴索溶液过评一直不太顺利,市场便也一直没能扩张开来。
而与此同时,吸入用乙酰半胱氨酸溶液过评企业又一家家增多,市场也持续扩张,最后逐渐强势抢占了吸入式祛痰药市场。2023年已达到了近30亿销售额,彼时吸入用盐酸氨溴索溶液才不到5亿。
盐酸氨溴索溶液在吸入用祛痰药领域里的优势地位到底是没保住。
虽然市场快被抢光了,且要做临床,但继续在研发吸入用盐酸氨溴索溶液的企业仍旧不少。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/wMV7rkGsJMsk6X52V3V9dA)



