III期临床有争议,拿II期临床找补
近日,大冢制药(Otsuka)和灵北制药(Lundbeck)在开发创伤后应激障碍(PTSD)市场的尝试中,遭到了FDA专家会的当头棒喝,专家会以10比1的票型一致反对该PTSD药物上市。
20多年来,PTSD药物市场一直没有什么新疗法问世,目前仅舍曲林和帕罗西汀两款SSRI类药物获批治疗,且疗效与副作用因人而异,大冢制药和灵北制药将打开市场的希望寄托于双方合作的抗精神病药物Rexulti,两家公司提议将Rexulti与舍曲林联合使用,以治疗创伤后应激障碍(PTSD)患者。
虽然专家会的结果不一定影响FDA的最终判断,如此一致的票型表明,两家公司拓展适应症的尝试很可能失败。
至于为何能产生如此一致的票型,简报文件已经给出了非常详细的解答。
Rexulti的审批历程
Rexulti是一种非典型抗精神病药物,是非典型抗精神病药物领域的后起之秀。
机制上,它是5-羟色胺(5-HT1A)和多巴胺D2受体的部分激动剂,同时是5-羟色胺(5-HT2A)受体和多巴胺α1/2受体的拮抗剂,对其他中枢单胺能受体亚型也有广泛的结合亲和力。
Rexulti最初于2015年7月在美国获批上市,用于治疗重度抑郁症(MDD)和精神分裂症。
随后,其适应症不断扩展,包括精神分裂症成人患者的维持治疗,以及阿尔茨海默病激越症状的治疗(尽管这一批准存在争议,因其临床试验中未能提供有临床意义的获益,并增加了死亡风险)。
理论上来说,在PTSD中,大冢制药和灵北制药期望的是突破单药SSRI的限制,舍曲林提升脑内5-羟色胺水平改善情绪焦虑,而Rexulti通过多神经递质系统(含5-羟色胺/多巴胺)发挥复杂机制,二者可能共同靶向PTSD不同症状维度,实现更全面缓解。
2024年年中,大冢制药和灵北制药申请将Rexulti的适应症扩展至创伤后应激障碍,FDA初步设定的决定目标日期为2025年2月8日。然而,今年1月,监管机构宣布将召开顾问委员会会议讨论该申请,因此需要延长审查期限。此次,简报文件发布正值专家会会前。而到目前为止,FDA尚未给出Rexulti新的目标行动日期。
临床结果“不一致”
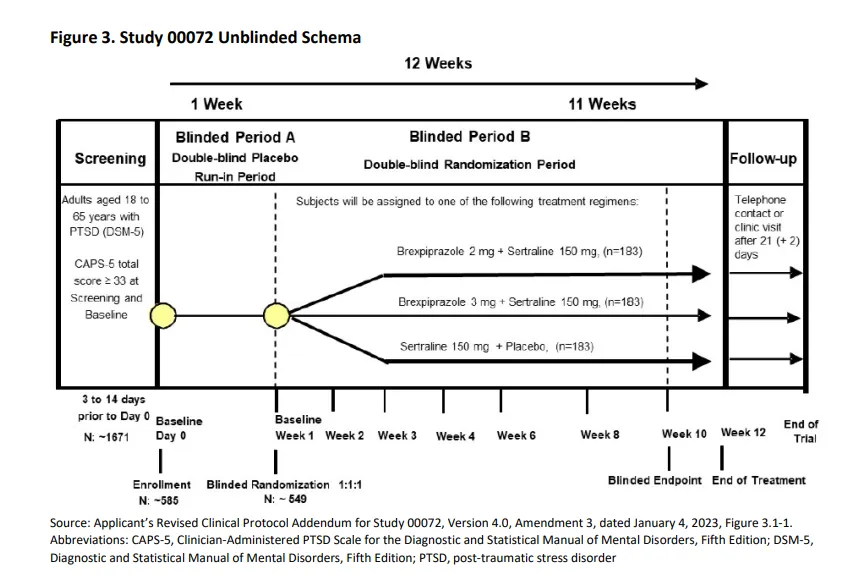
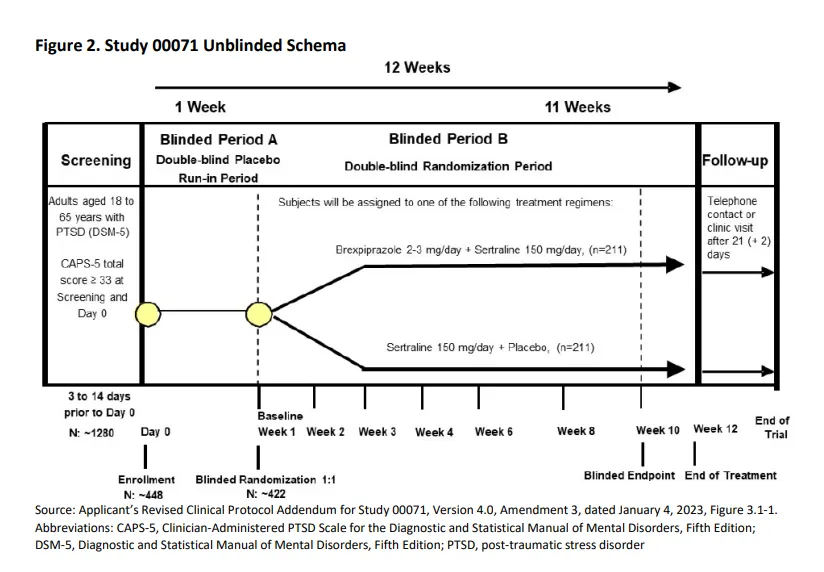
为了获批,两家公司开展了两项Ⅲ期试验以支持该药物的扩展应用:其中一项试验采用Rexulti灵活给药方案(Study 00071),另一项则采用固定剂量给药(Study 00072)。在这两项试验中,对照组均给予舍曲林加安慰剂。
Study 00071采用灵活给药的原因在于PTSD本身疾病的复杂异质性,理论上,灵活给药方案(如根据耐受性逐步滴定剂量)可更精准地找到个体化治疗剂量,避免固定剂量下部分患者因剂量不足疗效不佳,或因剂量过高出现副作用。
如果这两项研究都证明联合疗法显著优于安慰剂+舍曲林的话,或许通过审批也不会有问题了。
但问题是结果正好相左,灵活给药的方案(Study 00071)展现出显著阳性结果。(治疗差异CAPS-5评分-5.6;95%置信区间:-8.79,-2.38;p=0.0007),而固定给药(Study 00072)并未提供任何证据表明,甚至未显示该药物联合舍曲林有获益趋势,其估计平均差异非常接近零(治疗评分差异0.2;95%置信区间:-2.56,2.88;p=0.9073)。
FDA认为00072显然是一项完全阴性的结果,其主要终点或次要终点均未显示出统计学显著性。
由于两项结果完全矛盾,理论上FDA在这种情况下会要求开展另一项充分且良好对照的研究,以独立证实Study 00071的阳性结果。
然而,大冢制药和灵北制药提出的解决方案却是,将Ⅱ期临床Study 00061作为事后多重检验程序来证实结果。
Study 00061是一项Ⅱ期概念验证性研究,旨在探究布瑞哌唑单药治疗或联合舍曲林治疗的疗效,并为Ⅲ期研究设计提供假设。该试验得出名义上显著的结果,表明Rexulti联合舍曲林优于安慰剂联合安慰剂、舍曲林联合安慰剂以及Rexulti联合安慰剂。
作为概念性研究的00061是否能作为证据尚且不提,由于其本身并没有很好地进行控制变量,因此结果并不可信。
FDA指出,申请人(大冢制药和灵北制药)未遵循预先设定的分析计划进行分析,而是在试验完成后回顾性地选择了三项“有研究意义”的比较(如Rexulti联合舍曲林 vs. 舍曲林联合安慰剂),并采用事后多重性控制方法(如校正Ⅰ类错误率)进行分析。
使用回顾性方法时,Rexulti联合舍曲林显示统计学优势;但若采用最初预设的分层检验程序(按预先排序的假设逐步检验),则不能得出统计学显著性结论。
更关键的是三项回顾性选取的对比研究并非试验原设计的主要终点。例如:
在层级排序中,Rexulti联合舍曲林vs.舍曲林联合安慰剂的对比被“提升”为首要对比,但最初方案中它仅是第三个待检验的假设。
这种事后分析的“灵活性”可能导致结果偏向阳性,而预设方法更严格,能避免数据挖掘(data dredging)带来的假阳性。
显然,两家公司在临床试验上没有按照FDA的要求去做。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/bjjWQ3nOKQM3YFOfwitGuA)



