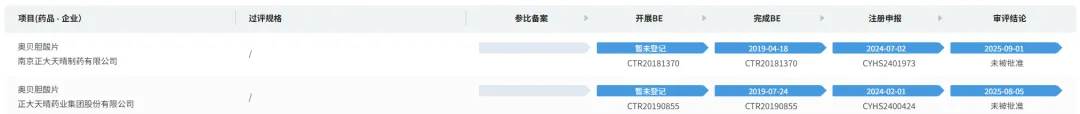
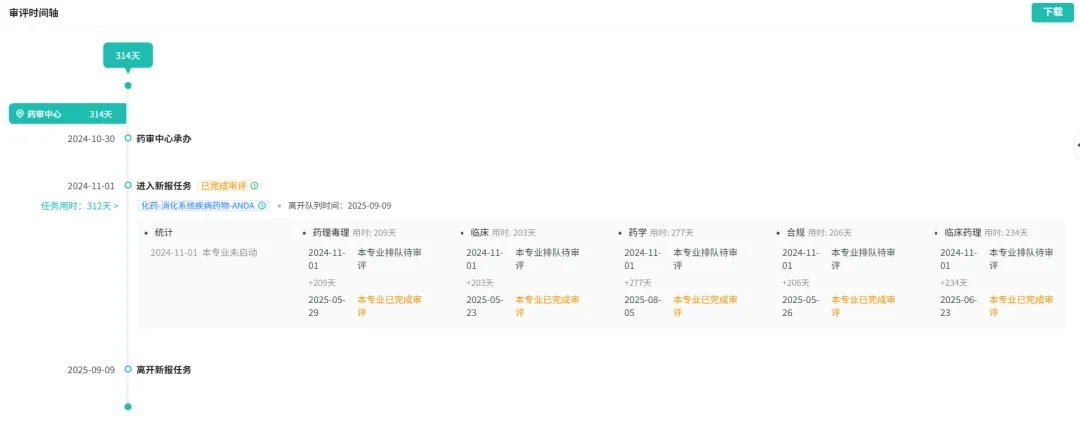
原研美国再撤市,仿制渺茫!
2025年9月11日,Intercept Pharmaceuticals宣布:应美国FDA的要求,自愿将用于治疗原发性胆汁性胆管炎 (PBC) 的药物 OCALIVA® (奥贝胆酸) 从美国市场撤回。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/Fu7LXDKIylSfkn2qbOtDTg)
2025年9月11日,Intercept Pharmaceuticals宣布:应美国FDA的要求,自愿将用于治疗原发性胆汁性胆管炎 (PBC) 的药物 OCALIVA® (奥贝胆酸) 从美国市场撤回。



*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/Fu7LXDKIylSfkn2qbOtDTg)
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 )
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 )
增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
GMT+8, 2025-9-13 04:14
声明:蒲公英网站所涉及的原创文章、文字内容、视频图片及首发资料,版权归作者及蒲公英网站所有,转载要在显著位置标明来源“蒲公英”;禁止任何形式的商业用途。违反上述声明的,本站及作者将追究法律责任。