强生看中的体内CAR-T平台,临床数据如何?
日前,Kelonia Therapeutics宣布其体内BCMA CAR-T候选药物KLN-101的1期临床研究inMMyCAR的首个临床数据,将在ASH 2025年会上进行口头报告。
值得注意的是,Kelonia在本月初与强生低调达成了关于体内CAR-T的战略合作,利用Kelonia专有的iGPS®(体内基因定位系统)平台,针对强生的目标靶点开发下一代体内CAR-T细胞疗法。这也是强生对于体内CAR-T的首次布局。
现今,Kelonia公布了其体内CAR-T技术平台iGPS®首个管线的临床数据,或许我们可以一窥强生选择Kelonia公司体内CAR-T技术的原因。
强生看中的iGPS®平台
iGPS®(体内基因定位系统)是一种基于慢病毒载体的体内基因递送技术平台,其通过对慢病毒进行修饰以提高体内基因转导效率,并对慢病毒进行工程化使其表达趋向性分子以实现组织特异性。

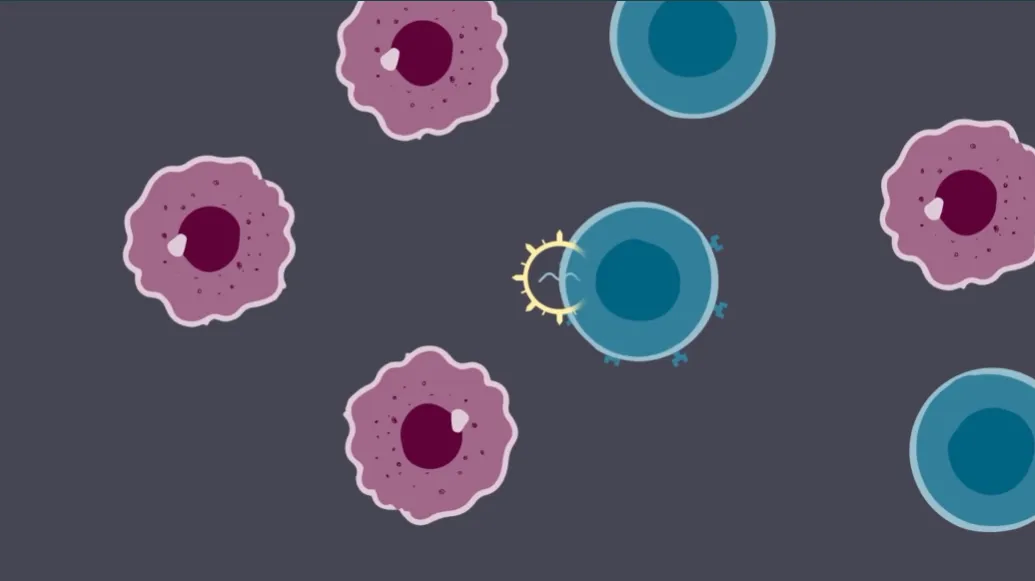
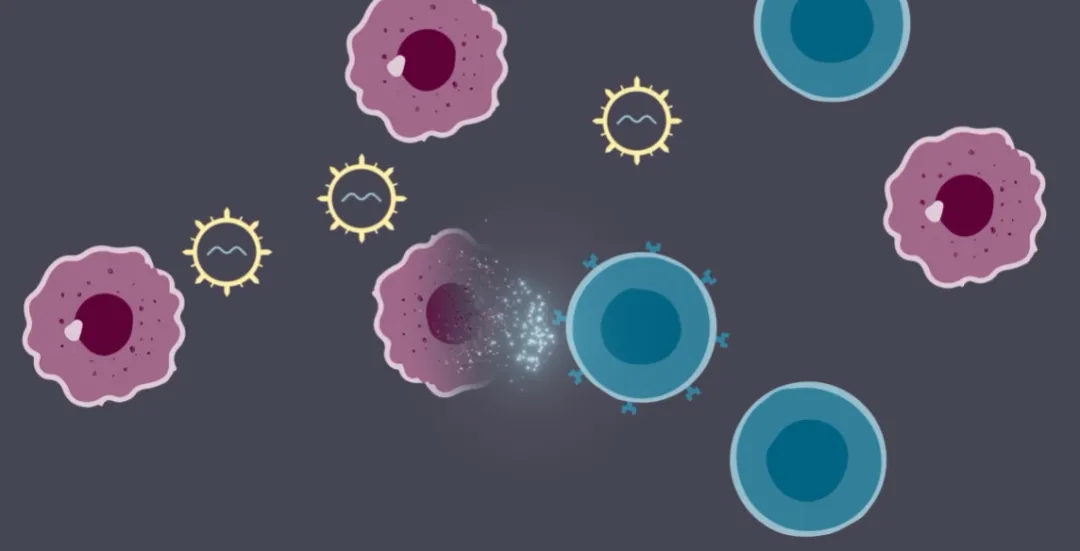
iGPS®平台示意图(图片来源:Kelonia公司官网)
目前,Kelonia公司正基于iGPS®平台构建一系列针对多种适应症的体内基因药物管线,其主要候选药物是KLN-1010,一款靶向BCMA的体内CAR-T细胞。
KLN-1010由一种改良的第三代慢病毒载体携带BCMA CAR基因,该慢病毒衣壳共表达一种经修饰的水泡性口炎病毒糖蛋白融合蛋白(vesicular stomatitis virus glycoprotein fusogen)和抗CD3抗体,使得病毒能够通过T细胞上的CD3进入细胞,而非通过低密度脂蛋白受体,从而实现对循环T细胞的特异性转导。另外,KLN-1010被设计为一种无需淋巴细胞清除化疗的现成疗法。
目前,KLN-1010正在进行1期临床试验inMMyCAR,评估KLN-1010用于治疗多发性骨髓瘤的安全性、耐受性和推荐的2期剂量(RP2D)。
首个临床数据公布
根据发布的ASH 2025摘要。
Kelonia公司报告了来自inMMyCAR研究的前三名患者数据,inMMyCAR是一项多中心1期、开放标签、剂量递增临床试验。
前3名患者年龄在61岁至72岁之间,从确诊到开始接受KLN-1010治疗的时间为7.9年至9.4年。所有患者均具有高风险的染色体遗传学特征,并且此前接受过3至4种治疗方案;有两名患者对PI(蛋白酶体抑制剂)、IMiD(免疫调节药物)和抗CD38治疗均不敏感。所有患者均未接受过BCMA靶向治疗;均未出现髓外病变。患者从同意治疗到开始输注的时间为13-18天。
安全性方面:所有患者均出现了治疗相关的不良事件(AE);在CAR-T细胞扩增期间,有2名患者出现了2级CRS;未观察到免疫效应细胞相关神经毒性综合征或迟发性神经毒性。
尽管未进行清淋预处理,CAR-T细胞仍然实现了扩增,其其绝对淋巴细胞计数(ALC)在第13至18天达到峰值。未观察到淋巴细胞增多的临床后遗症;在淋巴细胞增多计数最高的患者中,地塞米松迅速缓解了淋巴细胞增多症。在第3个月时,通过骨髓和外周血检测到CAR-T细胞,并且主要由记忆表型T细胞组成。
所有患者在第1个月时通过下一代流式细胞术或测序方法检测均实现了微小残留病(MRD)阴性反应(敏感性为10-5或10-6)。迄今为止,随访时间最长的患者在第三个月时仍保持MRD阴性(敏感性为10-6)。所有患者在第1个月时均根据国际骨髓瘤工作组(IMWG)标准达到了部分缓解,且这种缓解程度随着时间推移而加深,非常良好的部分缓解(VGPR)在第3个月时出现。所有患者均保持缓解状态,未出现疾病进展。
该研究的初步结果显示,体内BCMA CAR-T候选药物KLN-1010具有良好的临床疗效,且安全性可控。该研究仍在进行中,未来将公布更多更新数据。
小结
从体内CAR-T技术平台iGPS®首个管线的早期数据来看,其疗效和安全性还较为积极。
不过对于强生来说,手握全球畅销的BCMA CAR-T产品Carvykti,其在体内CAR-T研发热潮中,选择与Kelonia公司合作作为体内CAR-T的首次布局,Kelonia公司的iGPS®平台可能还有更大的潜力。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/MxsN9Vi8RAfe0MR4idIFiw)



