3期成功回应CRL,股价暴涨371%
2025年7月,Capricor Therapeutics的候选细胞药物Deramiocel的新药上市申请意外遭到美国FDA的拒绝,FDA发出的CRL中指出了疗效证据不足和CMC问题。
延伸阅读:基于外泌体的细胞疗法,意外被拒
在昨天(2025年12月3日),Capricor公司宣布Deramiocel的关键3期HOPE-3研究取得积极的总体结果,数据支持Deramiocel作为治疗杜氏心肌病的潜在首选疗法。基于该结果,Capricor公司计划与FDA进行讨论之后,将包含HOPE-3数据的文件作为对完整CRL的回应。

Deramiocel是一种基于外泌体作用的异体细胞治疗,由心球衍生细胞 (CDC) 组成,其通过分泌外泌体来进行免疫调节、抗炎和抗纤维化,以减缓DMD疾病进展。同时,CAP-1002的外泌体中包含有microRNA等活性物质,通过这类非编码RNA,能够改变巨噬细胞和其他靶细胞的基因表达,从而抑制DMD中的全身炎症,以及刺激组织再生长。
延伸阅读:含microRNA的药物申报上市
Capricor公司最早于2024年10月向FDA提交了Deramiocel的生物制品许可申请(BLA),用于治疗杜氏肌营养不良症(DMD)相关的心肌病。但是FDA在2025年7月(PDUFA日期前7周)拒批了Deramiocel,要求额外的临床数据以证明Deramiocel的疗效。
经过与FDA的沟通之后,Capricor公司于2025年9月宣布,FDA愿意根据Deramiocel的3期研究Hope-3的数据重新考虑。
实际上,HOPE-3早于2022年就已经启动了,在Capricor公司与FDA在2022年会面讨论Deramiocel的后续监管步骤之后。因此,Capricor公司能够快速满足FDA在CRL中提出的额外临床数据要求。
HOPE-3结果
HOPE-3是一项随机、双盲、安慰剂对照的三期临床试验,评估Deramiocel在患有DMD的男孩和年轻男性中的应用。该研究随机分配了106名参与者,分布在美国20个主要临床地点。参与者每3个月接受1次静脉输注Deramiocel(剂量为1.5亿细胞)或安慰剂,持续时间为12个月。参与者的平均年龄约为15岁,且所有参与者在整个研究期间均采用稳定的皮质类固醇方案。约90%的患者在基线接受心脏用药,超过75%的患者临床诊断为心肌病。
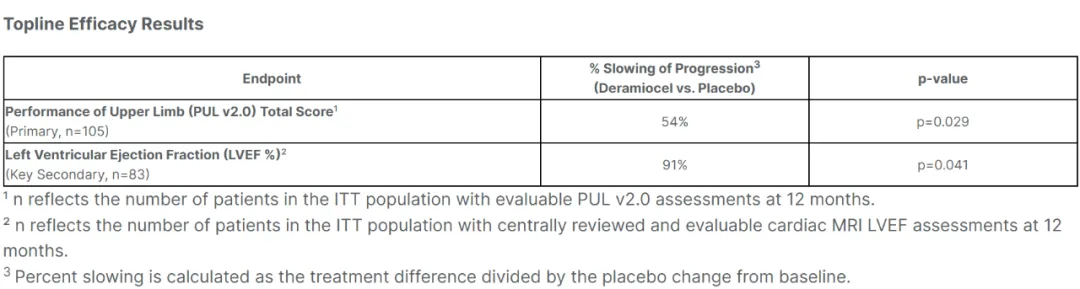
数据显示,HOPE-3满足主要终点(PUL v2.0)和关键次要心脏终点(LVEF),均达到统计显著性。与安慰剂相比,上肢功能(PUL v2.0)疾病进展减缓54%(p=0.029),左心室射血分数(LVEF)则减缓91%(p=0.041)。所有第一类错误控制的次要终点均实现了统计学显著性。
此外,HOPE-3结果显示其在骨骼和心脏方面具有临床意义和统计学显著的益处,支持Deramiocel作为治疗杜氏心肌病(杜氏心肌病的主要致死原因)的潜在首选疗法。
Deramiocel的安全性和耐受性与以往临床经验一致。
Capricor公司预计将于未来的科学会议上提交HOPE-3研究的详细结果,并在同行评审期刊上发表。
小结
事实上,根据Deramiocel一直表现出的疗效和安全性,Deramiocel很有可能赢得监管批准。
如果Deramiocel顺利获批,将成为首款用于治疗杜氏心肌病的药物。而根据分析师预测,如果Deramiocel顺利获批,其市场前景良好;在医生的交流中,医生表现出对Deramiocel的兴趣,但仍需查看更多数据;预计医生会倾向使用这种药物,尤其是其安全性较高。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/eQXSLoBPxGMG0lON3s_HTw)



