兴齐神药,全球首家,成功获批!
1月4日,沈阳兴齐眼药收到国家药监局核准签发的硫酸阿托品滴眼液《药品补充申请批准通知书》。

至此,中国近视儿童拥有了0.01%、0.02%、0.04%的完整浓度阶梯治疗方案。
截止目前,国内外尚无0.02%和0.04%硫酸阿托品滴眼液近视相关适应症产品获批上市,兴齐为全球首家。国外已有同类0.01%、0.025%硫酸阿托品滴眼液产品上市。
值得注意的是,兴齐的近视神药上市极为轰动,但后续的销售却并不如预料般好。
硫酸阿托品滴眼液上市后,券商机构预计均保持乐观。其中,国盛证券研报预计,兴齐眼药的阿托品滴眼液2024年收入有望达到约15亿元,在渗透率逐步提升的情况下,该产品在2030年收入有望达到约68亿元。
德邦证券预测中性情况下,兴齐眼药的阿托品滴眼液能在上市的第三个完整年(即2027年),达到101.8亿元的销售峰值。
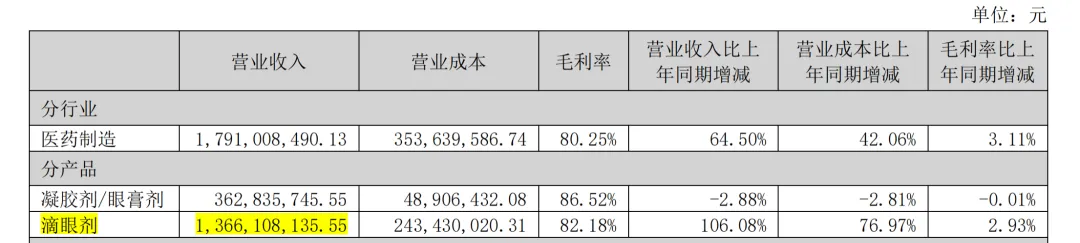
但根据年报,硫酸阿托品滴眼液的销售情况显然未达预期。兴齐眼药去年的滴眼剂系列(包括硫酸阿托品滴眼液在内)产品的整体销售额都未能达到15亿元,仅为13.66亿元。
与此同时,眼下兴齐还面临着来自恒瑞和兆科的竞争压力,恒瑞0.01%硫酸阿托品于2025年2月上市申请获受理,预计2026年上市;兆科同时拥有仿制0.01%和改良0.02%两个规格,另外覆盖儿童年龄更广,达到3-17岁。
兴齐的独家窗口期不久了。
好在此次兴齐扩充了两个规格,形成了完整治疗梯度,也算是很大程度巩固了自身竞争优势。
据兴齐公告披露,此次补充申请获批基于0.02%和0.04%阿托品滴眼液的Ⅲ期临床研究。
研究采用多中心、随机、双盲、安慰剂平行对照、优效性设计的试验方法。研究方案中关键指标、给药周期、停药后观察期设定均参照国家药监最新发布的《控制近视进展药物临床研究技术指导原则(2020年12月)》,共随机入组800例,给药期2年,停药观察期1年,研究结果显示,0.02%和 0.04%阿托品滴眼液与安慰剂相比,均能够有效延缓儿童近视进展,且总体安全性良好。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/5EC0LjulFcNDmoO4VQc6mA)



